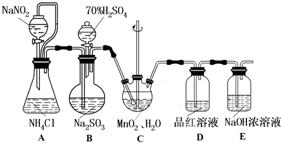
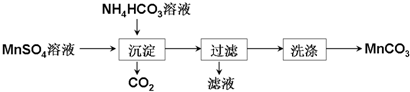
题目内容
12.有八种物质:①甲烷;②苯;③聚乙烯;④聚异戊二烯;⑤2丁炔;⑥环己烷;⑦邻二甲苯;⑧环己烯,既能使酸性KMnO4溶液褪色,又能与溴水反应使之褪色的是( )| A. | ①④⑤⑧ | B. | ②⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
分析 既能使酸性KMnO4溶液褪色,又能与溴水反应使之褪色,则有机物中含碳碳双键、三键、-CHO等,以此来解答.
解答 解:①甲烷、②苯、③聚乙烯、⑥环己烷均与高锰酸钾、溴水不反应;
⑦邻二甲苯与高锰酸钾反应,而与溴水不反应;
只有④聚异戊二烯、⑤2丁炔、⑧环己烯均与高锰酸钾发生氧化反应,与溴水发生加成反应,既能使酸性KMnO4溶液褪色,又能与溴水反应使之褪色,
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意常见有机物的性质及应用,题目难度不大.

练习册系列答案
相关题目
2.在元素周期表中,所含元素种类最多的族是( )
| A. | Ⅷ族 | B. | ⅠA族 | C. | 0族 | D. | ⅢB族 |
3.反应4A(s)+3B(g)?2C(g)+D(g),经2min后,B的浓度减少了0.6mol•L-1.对此反应速率的叙述正确的是( )
| A. | 用A表示的反应速率是0.4 mol•L-1•min-1 | |
| B. | 分别用B、C、D表示反应的速率,其比值是3:2:1 | |
| C. | 在2 min末时的反应速率,用反应物B来表示是0.3 mol•L-1•min-1 | |
| D. | 在这2 min内用B和C表示的反应速率的值都是相同的 |
7.一定温度下,在一定容积的密闭容器中加入 NH3和 O2 各1mol,发生反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g).下列说法中,表明该反应达到化学平衡状态的是( )
| A. | 气体的密度不再变化 | B. | NH3和 NO 的反应速率相等 | ||
| C. | 反应速率不再变化 | D. | NO 和H2O 浓度比不再变化 |
17.己知N2(g)+3H2(g)?2NH3(g)△H<0.图是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线.
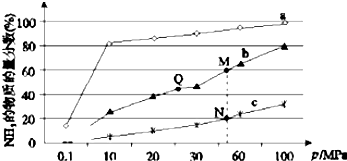
关于工业合成氨的反应,下列叙述不正确的是( )

关于工业合成氨的反应,下列叙述不正确的是( )
| A. | 上图中M、N、Q点平衡常数K 的大小关系为K(M)=K(Q)>K(N) | |
| B. | 加催化剂能加快反应速率但H2的平衡转化率不变 | |
| C. | 相同压强条件下,投料相同,达到平衡所需时间关系为a>b>c | |
| D. | 由曲线a可知,当压强增加到10OMPa以上,NH3的物质的量分数可达到100% |
4.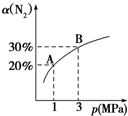 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )| A. | 平衡状态由A变到B时,平衡常数K(A)=K(B) | |
| B. | 将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ | |
| C. | 升高温度,逆反应速率增大,正反应速率减小 | |
| D. | 上述反应达到平衡后,增大H2浓度,平衡正向移动,H2转化率增大 |