题目内容
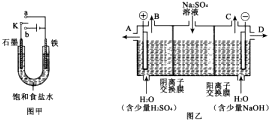 (1)某课外活动小组同学用图甲装置进行实验,试答下列问题:
(1)某课外活动小组同学用图甲装置进行实验,试答下列问题:①若开始时开关K与a连接,则铁发生电化学腐蚀中的
②若开始时开关K与b连接,则总反应的离子方程式为
(2)芒硝化学式Na2SO4?l0H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用图乙所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是提高原料的利用率而言都更加符合绿色化学理念.
①此时通过阴离子交换膜的离子数
②制得的氢氧化钠溶液从出口
③通电开始后,阴极附近溶液pH会增大,请简述原因
④若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)①中性条件下,铁发生吸氧腐蚀;
②若开始时开关K与b连接,Fe为阴极,石墨为阳极,电解饱和食盐水;
(2)①根据阴阳离子的移动方向,通过相同电量时,阴阳离子交换的个数判断;
②阴极上氢离子放电,则NaOH在阴极生成;
③电解过程中氢离子在阴极得到电子发生还原反应,破坏了水的电离,溶液中氢氧根离子浓度增大,溶液PH升高;
④氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,负极上氢气失去电子.
②若开始时开关K与b连接,Fe为阴极,石墨为阳极,电解饱和食盐水;
(2)①根据阴阳离子的移动方向,通过相同电量时,阴阳离子交换的个数判断;
②阴极上氢离子放电,则NaOH在阴极生成;
③电解过程中氢离子在阴极得到电子发生还原反应,破坏了水的电离,溶液中氢氧根离子浓度增大,溶液PH升高;
④氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,负极上氢气失去电子.
解答:
解:(1)①中性条件下,铁发生吸氧腐蚀,故答案为:吸氧;
②若开始时开关K与b连接,Fe为阴极,石墨为阳极,电解饱和食盐水,阴极上氢离子得电子生成氢气和氢氧根离子,阳极上氯离子失电子生成氯气,则电解的离子方程式为:2Cl-+2H2O
2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑;
(2)①阳极氢氧根离子放电,因此硫酸根离子向阳极移动,阴极氢离子放电,因此钠离子向阴极移动,所以通过相同电量时,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数,
故答案为:小于;
②阴极上氢离子放电,则NaOH在阴极生成,由图可知,D在阴极附近,制得的氢氧化钠溶液从D出口导出,故答案为:D;
③电解过程中氢离子在阴极得到电子发生还原反应,破坏了水的电离,溶液中氢氧根离子浓度增大,溶液pH升高,故答案为:氢离子放电生成氢气促进水的电离,溶液中氢氧根离子浓度增大;
④氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,负极上氢气失去电子,负极反应式为H2-2e-+2OH-=2H2O,故答案为:H2-2e-+2OH-=2H2O.
②若开始时开关K与b连接,Fe为阴极,石墨为阳极,电解饱和食盐水,阴极上氢离子得电子生成氢气和氢氧根离子,阳极上氯离子失电子生成氯气,则电解的离子方程式为:2Cl-+2H2O
| ||
| ||
(2)①阳极氢氧根离子放电,因此硫酸根离子向阳极移动,阴极氢离子放电,因此钠离子向阴极移动,所以通过相同电量时,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数,
故答案为:小于;
②阴极上氢离子放电,则NaOH在阴极生成,由图可知,D在阴极附近,制得的氢氧化钠溶液从D出口导出,故答案为:D;
③电解过程中氢离子在阴极得到电子发生还原反应,破坏了水的电离,溶液中氢氧根离子浓度增大,溶液pH升高,故答案为:氢离子放电生成氢气促进水的电离,溶液中氢氧根离子浓度增大;
④氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,负极上氢气失去电子,负极反应式为H2-2e-+2OH-=2H2O,故答案为:H2-2e-+2OH-=2H2O.
点评:本题考查了原电池和电解池原理,注意装置的判断及燃料原电池电极反应式和电解反应的书写,理解电解质溶液的酸碱性确定生成的离子或物质,题目难度中等.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
钠与铯都是碱金属元素,下列关于铯及其化合物的叙述中不正确的是( )
| A、其单质在常温下与H2O的反应比Na更剧烈 |
| B、其单质能从NaCl水溶液中置换出Na |
| C、CsOH属于强碱,其碱性强于NaOH |
| D、其单质极易被氧化,可保存在煤油中 |
国家游泳中心(俗称“水立方”)采用了高分子膜材料“ETFE”,该材料是四氟乙烯(CF2=CF2)与乙烯(CH2=CH2)发生聚合反应得到的高分子材料.下列说法不正确的是( )
| A、“ETFE”分子中可能存在“-CH2-CH2-CF2-CF2-”的连接方式 |
| B、合成“ETFE”的反应为加聚反应 |
| C、CF2=CF2和CH2=CH2均是平面形分子 |
| D、CF2=CF2可由CH3CH3与F2两种物质直接反应制得 |
下列叙述错误的是( )
| A、随着原子序数增多,碱金属的原子半径逐渐增大 |
| B、卤素单质的熔沸点随着原子序数的增大而降低 |
| C、离子化合物中肯定含离子键 |
| D、原电池的负极发生氧化反应 |
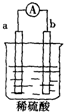 如图所示的装置中,a在金属活动顺序表中位于氢前,b为碳棒,关于此装置的各种叙述不正确的是( )
如图所示的装置中,a在金属活动顺序表中位于氢前,b为碳棒,关于此装置的各种叙述不正确的是( )| A、导线中有电子流动,电子从a极流到b极 |
| B、碳棒上有气体放出,溶液pH变大 |
| C、a极上发生了氧化反应 |
| D、a是正极,b是负极 |
潜艇上的核反应堆使用液态铝钠合金(单质钠和单质铝熔合而成)作载热介质,下列有关说法正确的是( )
| A、该合金的熔点介于钠、铝之间 |
| B、钠或铝形成的氧化物均为碱性氧化物 |
| C、钠和铝分别与不足量的盐酸反应,所得溶液均呈中性 |
| D、若合金中n(Na)>n(Al),将其投入到足量的水中,可得无色透明溶液 |
 ,下列叙述正确的有
,下列叙述正确的有