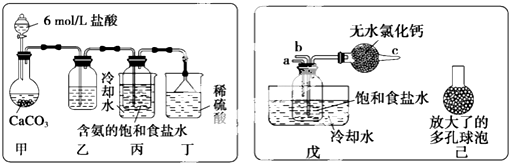
题目内容
15.在500mL溶质为feCl3、HCl、CuSO4的混合溶液中.加入足量的铁粉充分反应后,溶液质量增加了mg,此时溶液中Fe2+的物质的量与原混合溶液中Cu2+的物质的量之比为2:1,则原混合溶液中SO42-与Cl-的物质的量浓度之比是1:2.分析 加入足量铁粉,则溶液中FeCl3、HCl、CuSO4完全反应生成FeCl2、FeSO4,反应后溶液中Fe2+的物质的量与原混合溶液中Cu2+的物质的量之比为2:1,设Cu2+的物质的量为n,则反应后溶液中Fe2+的物质的量为2n,根据反应Cu2++Fe=Cu+Fe2+可知,反应后生成的FeSO4的物质的量为n,则原溶液中硫酸根离子的物质的量为n;原溶液中FeCl3、HCl与Fe完全反应生成的FeCl2的物质的量为n,根据质量守恒可知Cl-的物质的量为:n(Cl-)=2n(FeCl2)=2n,再根据在同一溶液中c(SO42-):c(Cl-)=n(SO42-):n(Cl-)计算出原混合溶液中SO42-与Cl-的物质的量浓度之比.
解答 解:加入的铁粉足量,则溶液中FeCl3、HCl、CuSO4完全反应生成FeCl2、FeSO4,
反应后溶液中Fe2+的物质的量与原混合溶液中Cu2+的物质的量之比为2:1,设Cu2+的物质的量为n,则反应后溶液中Fe2+的物质的量为2n,
根据反应Cu2++Fe=Cu+Fe2+可知,反应后生成的FeSO4的物质的量为n,则硫酸根离子的物质的量为n,
原溶液中FeCl3、HCl与Fe完全反应生成的FeCl2的物质的量为n,根据质量守恒可知Cl-的物质的量为:n(Cl-)=2n(FeCl2)=2n,
由于在同一溶液中,则原溶液c(SO42-):c(Cl-)=n(SO42-):n(Cl-)=n:2n=1:2,
故答案为:1:2.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的化学计算能力.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
5.反应N2(g)+3H2(g)?2NH3(g)△H<0;若升温,则反应速率v(正)、v(逆)的变化是( )
| A. | 同时减少 | B. | 同时增大 | C. | v(正)增大,v(逆)减少 | D. | v(正)减少,v(逆)增大 |
6.W、X、Y、Z是原子序数依次增大的四种短周期主族元素,W原子在周期表中原子半径最小,X与Y原子最外层电子数之和为8,X的最高正价与最低负价代数和为2,Z原子的最外层电子数是Y原子最外层电子数的2倍,下列说法正确的是( )
| A. | 单质沸点:X>Y | B. | 阳离子的氧化性:W>Y | ||
| C. | 氧化物的水化物的酸性:Z>X | D. | Y、Z的简单离子均能抑制水的电离 |
3.下列说法正确的是( )
| A. | 酸式盐的水溶液一定显酸性 | |
| B. | 碳酸溶液中的氢离子浓度是碳酸根离子浓度的2倍 | |
| C. | 室温下,pH=3的亚硫酸溶液中的氢离子浓度与pH=11的氨水中的氢氧根离子浓度相等 | |
| D. | 室温时,将pH=5的H2SO4溶液稀释1000倍,则c(H+):c (SO42-)=2:1 |
10. 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.Na2CO3 b.NaHCO3 c.NaClO d.CH3COONa.它们的pH由大到小排列的顺序是a>c>b>d (填编号).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BC.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$
C.$\frac{c(O{H}^{-})}{c({H}^{+})}$ D.c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
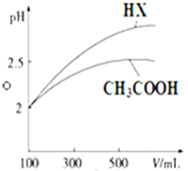
(3)CH3COOH与一元酸HX的溶液均为100mL、pH=2,加水稀释过程中pH与溶液体积的关系如图所示,则同温度时CH3COOH的电离平衡常数小于(填“大于”、“小于”或“等于”) HX的电离平衡常数.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(保留两位有效数字).
 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.Na2CO3 b.NaHCO3 c.NaClO d.CH3COONa.它们的pH由大到小排列的顺序是a>c>b>d (填编号).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BC.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$
C.$\frac{c(O{H}^{-})}{c({H}^{+})}$ D.c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
(3)CH3COOH与一元酸HX的溶液均为100mL、pH=2,加水稀释过程中pH与溶液体积的关系如图所示,则同温度时CH3COOH的电离平衡常数小于(填“大于”、“小于”或“等于”) HX的电离平衡常数.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(保留两位有效数字).
20.有一铁粉和氧化铜的混合物8.32g,进行如图实验.

根据实验所得数据,有关说法正确的是( )

根据实验所得数据,有关说法正确的是( )
| A. | 无色气体的质量为0.2g | |
| B. | 原混合物中铁的质量分数无法计算 | |
| C. | 实验中消耗的H2SO4物质的量为0.1mol | |
| D. | 溶液中金属离子物质的量为0.02mol |
3.恒温恒容的容器内发生如下反应:2NO2(g)?N2O4(g)达平衡时,再向容器内通入一定量的N2O4(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数( )
| A. | 不变 | B. | 增大 | C. | 减小 | D. | 无法判断 |
4.下列鉴别方法可行的是( )
| A. | 用稀氨水鉴别Al3+、Mg2+和Ag+ | |
| B. | 用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 | |
| C. | 用酸性KMnO4溶液鉴别CH3CH═CHCH2OH和CH3CH2CH2CHO | |
| D. | 用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32- |