题目内容
3.下列说法正确的是( )| A. | 酸式盐的水溶液一定显酸性 | |
| B. | 碳酸溶液中的氢离子浓度是碳酸根离子浓度的2倍 | |
| C. | 室温下,pH=3的亚硫酸溶液中的氢离子浓度与pH=11的氨水中的氢氧根离子浓度相等 | |
| D. | 室温时,将pH=5的H2SO4溶液稀释1000倍,则c(H+):c (SO42-)=2:1 |
分析 A.酸式盐的水溶液可能呈碱性,如碳酸氢钠溶液;
B.碳酸是弱酸,不能完全电离,二级电离远远小于一级电离;
C.根据pH值计算氢离子浓度,再根据水的离子键计算氨水中氢氧根离子浓度;
D.pH=5的H2SO4溶液中H+浓度为10-5mol/L、SO42-浓度为0.5×10-5mol/L,稀释1000倍后c(H+)≈10-7mol/L,c (SO42-)=0.5×10-8mol/L.
解答 解:A.酸式盐的水溶液不一定呈酸性,可能呈碱性,如碳酸氢钠溶液,故A错误;
B.碳酸是弱酸,不能完全电离,二级电离远远小于一级电离,氢离子浓度远大于碳酸根离子浓度的2倍,故B错误;
C.pH=3的亚硫酸溶液中的氢离子浓度为10-3mol/L,pH=11的氨水中的氢氧根离子浓度为$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=10-3mol/L,浓度相等,故C正确;
D.pH=5的H2SO4溶液中H+浓度为10-5mol/L、SO42-浓度为0.5×10-5mol/L,稀释1000倍后c(H+)≈10-7mol/L,c (SO42-)=0.5×10-8mol/L,故溶液稀释1000倍后c(H+):c (SO42-)=10-7mol/L:0.5×10-8mol/L=20:1,故D错误,
故选:C.
点评 本题考查溶液pH有关计算、弱电解质电离等,D选项注意酸或碱稀释接近中性时应考虑水电离产生的氢离子或氢氧根离子.

练习册系列答案
相关题目
13.下列物质不能用单质直接化合而成的是( )
| A. | FeS | B. | SO3 | C. | FeCl3? | D. | HgS |
14.设NA表示阿伏伽德罗常数的值,下列叙述中不正确的是( )
| A. | 室温下,46gNO2和N2O4的混合气体中含有NA个氮原子 | |
| B. | 1mol12C18O2中所含的中子数为26NA | |
| C. | 常温下,1L0.1mol/LCH3COONa溶液中含有CH3COO-和Na+总数为0.2NA | |
| D. | 常温下,1LpH=12的氨水中含有OH-的数目为0.01NA |
8.莫尔盐[(NH4)2Fe(SO4)2•6H2O]常作氧化还原滴定法的基准物质,在0.1mol/L 的该盐的溶液中,下列有关比较正确的是( )
| A. | c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | B. | c(H+)=c(OH-)+c(NH3•H2O) | ||
| C. | c(SO42-)+c(OH-)=c(NH4+)+c(Fe2+)+c(H+) | D. | c(NH3•H2O)+c(NH4+)=0.1 mol/L |
12. 如图所示,温度不变下某容器分隔AB两部分,A容积固定不变,B有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2mol SO3和1molN2,开始时活塞停在3处.在相同条件下发生可逆反应:2SO3(g)?2SO2(g)+O2(g),则下列说法正确的是( )
如图所示,温度不变下某容器分隔AB两部分,A容积固定不变,B有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2mol SO3和1molN2,开始时活塞停在3处.在相同条件下发生可逆反应:2SO3(g)?2SO2(g)+O2(g),则下列说法正确的是( )
 如图所示,温度不变下某容器分隔AB两部分,A容积固定不变,B有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2mol SO3和1molN2,开始时活塞停在3处.在相同条件下发生可逆反应:2SO3(g)?2SO2(g)+O2(g),则下列说法正确的是( )
如图所示,温度不变下某容器分隔AB两部分,A容积固定不变,B有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2mol SO3和1molN2,开始时活塞停在3处.在相同条件下发生可逆反应:2SO3(g)?2SO2(g)+O2(g),则下列说法正确的是( )| A. | A中的压强大于B中的压强 | |
| B. | A中的SO2浓度小于B中SO2浓度 | |
| C. | A中的SO3浓度小于B中SO3浓度 | |
| D. | 将A改为可移动的活塞,达平衡时,A 停在0左侧0.5 处,则B可能停在0右侧3.2处 |
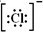 ;SO3的沸点为44.8℃,其汽化时需克服的作用力是分子间作用力.
;SO3的沸点为44.8℃,其汽化时需克服的作用力是分子间作用力.