题目内容
12.分子式为C4H8ClBr的有机物共有(不含立体异构)( )| A. | 15种 | B. | 14种 | C. | 13种 | D. | 12种 |
分析 C4H8ClBr可以看作C4H10中2个H原子被Cl、Br原子取代,而丁烷有CH3CH2CH2CH3、CH3CH(CH3)2两种,据此分析.
解答 解:C4H8ClBr可以看作C4H10中2个H原子被Cl、Br原子取代,而丁烷有CH3CH2CH2CH3、CH3CH(CH3)2两种,
先分析碳骨架异构,分别为 C-C-C-C 与 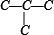 2种情况,然后分别对2 种碳骨架采用“定一移一”的方法分析,其中骨架 C-C-C-C 有
2种情况,然后分别对2 种碳骨架采用“定一移一”的方法分析,其中骨架 C-C-C-C 有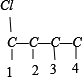 、
、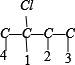 共 8 种,骨架
共 8 种,骨架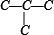 有
有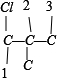 、
、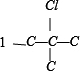 ,共 4 种,共12种,
,共 4 种,共12种,
故选D.
点评 本题考查同分异构体的书写,难度中等,注意氯原子或溴原子取代中间碳原子上的氢原子结构不同,侧重于考查学生的分析能力.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
5.《天工开物》对某种颜料“朱”制备的描述为:“夫亦依坎附离,而共呈五行变态.”所述“朱”的制备,用水银一斤和过量的硫(石亭脂)进行反应,得到上朱十四两、次朱三两五钱,共得朱十七两五钱(当时一斤等于十六两).有关该反应的描述正确的是( )
| A. | “朱”的主要成分是Hg2S | B. | 该反应为置换反应 | ||
| C. | 该反应不符合质量守恒定律 | D. | 该反应Hg作还原剂 |
3.下列说法正确的是( )
| A. | 用PH试纸测定氯水的PH | |
| B. | 用硫酸镁溶液除去氢氧化镁中的氢氧化钙 | |
| C. | 用KSCN溶液检验Fe2+的存在 | |
| D. | 液溴保存时通常要加少量水液封 |
20.实验室制备一硝基甲苯(主要含邻硝基甲苯和对硝基甲苯)的反应原理、实验装置如图:
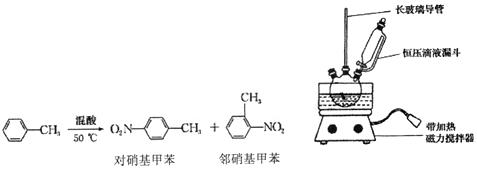
实验步骤:
①配制混酸,组装如图反应装置.取100mL 烧杯,用10mL 浓硫酸与30mL 浓硝酸配
制混酸,加入恒压滴液漏斗中,把15mL 甲苯(折合质量13.0g)加入三颈烧瓶中.
②向室温下的甲苯中逐滴加混酸,边滴边搅拌,混合均匀.
③在50一60℃下发生反应,直至反应结束.
④除去混酸后,依次用蒸馏水和10% NaCO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
请回答下列问题:
(l)配制40mL 混酸的操作是分别取30mL浓硝酸和10mL浓硫酸,将30mL浓硝酸倒入烧杯中,再慢慢沿烧杯内壁注入10mL浓硫酸,边加边搅拌.
(2)装置中还缺少温度计 (填仪器名称).如果温度超过60℃,将会有二硝基甲苯或三硝基甲苯(填物质名称)生成.
(3)分离粗产品和水的操作方法是分液.
(4)产品用10% NaCO3溶液洗涤之后,再用蒸馏水洗涤,检验产品是否洗干净的操作是取最后一次洗涤液少许于试管中,滴加氯化钙溶液,无沉淀生成,则说明已洗净.
(5)为了得到更纯净的硝基苯,还须先向液体中加入CaO 除去水,然后蒸馏,若最终得到产品的质量为13.70g,则一硝基甲苯的产率是70.8%.

| 密度/(g•cm-3) | 沸点/℃ | 式量 | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 92 | 不溶于水,易溶于一硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 137 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 137 | 不溶于水,易溶于液态烃 |
①配制混酸,组装如图反应装置.取100mL 烧杯,用10mL 浓硫酸与30mL 浓硝酸配
制混酸,加入恒压滴液漏斗中,把15mL 甲苯(折合质量13.0g)加入三颈烧瓶中.
②向室温下的甲苯中逐滴加混酸,边滴边搅拌,混合均匀.
③在50一60℃下发生反应,直至反应结束.
④除去混酸后,依次用蒸馏水和10% NaCO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
请回答下列问题:
(l)配制40mL 混酸的操作是分别取30mL浓硝酸和10mL浓硫酸,将30mL浓硝酸倒入烧杯中,再慢慢沿烧杯内壁注入10mL浓硫酸,边加边搅拌.
(2)装置中还缺少温度计 (填仪器名称).如果温度超过60℃,将会有二硝基甲苯或三硝基甲苯(填物质名称)生成.
(3)分离粗产品和水的操作方法是分液.
(4)产品用10% NaCO3溶液洗涤之后,再用蒸馏水洗涤,检验产品是否洗干净的操作是取最后一次洗涤液少许于试管中,滴加氯化钙溶液,无沉淀生成,则说明已洗净.
(5)为了得到更纯净的硝基苯,还须先向液体中加入CaO 除去水,然后蒸馏,若最终得到产品的质量为13.70g,则一硝基甲苯的产率是70.8%.
4.化学与生活、生产、可持续发展密切相关,下列说法中正确的是( )
| A. | 14C可用于文物年代的鉴定,14C和12C互为同素异形体 | |
| B. | 在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因 | |
| C. | 高纯度的SiO2可以制成光电池将光能直接转化为电能 | |
| D. | 现代工业生产中芳香烃主要来源于石油化工的催化重整和煤的干馏 |
2.在氯化亚铁溶液中,加入氯水,振荡后溶液变为黄色.
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的粒子是Cl2;乙同学认为这是发生化学反应所致,使溶液变黄色的粒子是Fe3+;(以上2空填相应微粒的符号)
(2)现提供以下试剂:
A.酸性高锰酸钾溶液
B.氢氧化钠溶液
C.四氯化碳
D.硫氰化钾溶液
请判断哪位同学的推断是正确的,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象.
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的粒子是Cl2;乙同学认为这是发生化学反应所致,使溶液变黄色的粒子是Fe3+;(以上2空填相应微粒的符号)
(2)现提供以下试剂:
A.酸性高锰酸钾溶液
B.氢氧化钠溶液
C.四氯化碳
D.硫氰化钾溶液
请判断哪位同学的推断是正确的,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象.
| 乙同学正确 | 选用试剂 | 实验现象 |
| 第一种方法 | ||
| 第二种方法 |
3.研究人员最近发现了“水”电池.这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是( )
| A. | Na2Mn5O10是氧化产物 | |
| B. | 正极反应式:Ag-e-═Ag+ | |
| C. | Cl-不断向“水”电池的正极移动 | |
| D. | 毎转移2mol电子,负极质量增加71克 |
 甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.有关反应的热化学方程式如下:
甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.有关反应的热化学方程式如下: