题目内容
19.中学化学中几种常见物质的转化关系如下图(部分产物未列出).A是一种生活中常见金属单质之一,D是淡黄色固体单质.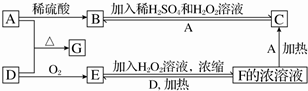
请回答下列问题:
(1)A、G的化学式分别为AFe,GFeS;
(2)用物理方法洗去试管内壁的D,应选择的试剂是CS2;
(3)F的浓溶液与A反应过程中,F体现的性质与下列反应中H2SO4体现的性质完全相同的是C(填字母);
A.C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
B.Fe+H2SO4═FeSO4+H2↑
C.Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
D.FeO+H2SO4═FeSO4+H2O
(4)写出反应E+H2O2→F的离子反应方程式:SO2+H2O2═2H++SO42-;
(5)写出B→C的离子反应方程式:2Fe2++H2O2+2H+=2Fe3++2H2O;
(6)若足量A与少量F在加热条件下反应,得到E和另一种气体,其体积比为1:1,则参加反应的A与F的物质的量之比为2:3.
分析 由A和稀硫酸反应生成B,B和稀硫酸的过氧化氢混合溶液反应生成C,说明A为变价金属,可推知A为Fe,B为FeSO4,C为Fe2(SO4)3,由F→C可推知F为H2SO4,D是淡黄色固体单质,进而推出D为S,E为SO2,G为FeS,故F+D→E为2H2SO4(浓)+S═3SO2↑+2H2O,据此解答,
(1)上述分析可知A为Fe,G为FeS;
(2)硫单质难溶于水,微溶于酒精,易溶于二硫化碳,与强碱溶液反应;
(3)F的浓溶液与A反应过程中,硫酸体现强氧化性、酸性,A选项中浓硫酸只体现强氧化性,B选项中硫酸体现弱氧化性,C选项中浓硫酸体现强氧化性、酸性,D选项中硫酸体现酸性;
(4)反应E+H2O2→F的离子反应是二氧化硫被过氧化氢氧化为硫酸的反应;
(5)B-C的反应是酸性溶液中亚铁离子被过氧化氢氧化为铁离子,本身被还原为水;
(6)若足量A为Fe与少量F为浓硫酸在加热条件下反应,得到E为二氧化硫和另一种气体为,浓硫酸随反应进行浓度减小,最后生成的是氢气,其体积比为1:1,结合电子守恒分析配平化学方程式计算得到.
解答 解:由A和稀硫酸反应生成B,B和稀硫酸的过氧化氢混合溶液反应生成C,说明A为变价金属,可推知A为Fe,B为FeSO4,C为Fe2(SO4)3,由F→C可推知F为H2SO4,D是淡黄色固体单质,进而推出D为S,E为SO2,G为FeS,故F+D→E为2H2SO4(浓)+S═3SO2↑+2H2O,
(1)由上述分析可知,A为Fe,G为FeS,故答案为:Fe;FeS;
(2)用物理方法洗去试管内壁的D,应选择的试剂是利用硫单质易溶于二硫化碳洗涤,故答案为:CS2;
(3)F的浓溶液与A反应过程中,硫酸体现强氧化性、酸性,
A.选项中浓硫酸只体现强氧化性,无酸性体现,故A错误;
B.选项中硫酸体现弱氧化性,是氢离子的氧化性,无强氧化性,故B错误;
C.选项中生成硫酸铜和二氧化硫,浓硫酸体现强氧化性、酸性,故C正确;
D.选项中硫酸体现酸性,无意思化合价变化,无强氧化性体现,故D错误;
故答案为:C;
(4)E+H2O2→F的反应是利用过氧化氢的氧化性和二氧化硫的还原性,发生氧化还原反应生成硫酸,反应的化学方程式为:SO2+H2O2═2H++SO42-,
故答案为:SO2+H2O2═2H++SO42-;
(5)B-C的反应是酸性溶液中亚铁离子被过氧化氢氧化为铁离子,本身被还原为水,结合电荷守恒、原子守恒配平书写离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(6)若足量A为Fe与少量F为浓硫酸在加热条件下反应,得到E为二氧化硫和另一种气体为,浓硫酸随反应进行浓度减小,最后生成的是氢气,溶液中的盐为硫酸亚铁,其体积比为1:1,则分数反应的化学方程式为:2Fe+3H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2FeSO4+SO2↑+H2↑+2H2O,故则参加反应的A与F的物质的量之比为2:3,
故答案为:2:3.
点评 本题考查无机物的推断,涉及Fe、S元素单质及其化合物的性质,根据“金属A与硫酸反应生成B,B能氧化生成C”推断B为变价金属性,是推断的突破口,需要学生具备一定的推理能力与扎实的基础知识,题目难度中等.

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案| A. | ①②③④ | B. | ①②④⑤ | C. | ②④⑤ | D. | ②③④ |
| A. |  验证铁的析氢腐蚀 | B. |  吸收SO2 | ||
| C. |  制取少量氨气 | D. |  制取无水MgCl2 |
| A. | 在标准状况下,NA个SO2分子所占的体积约为22.4L | |
| B. | 在标准状况下,1L庚烷(C7H16)完全燃烧生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| C. | 7gCnH2n中含有的共价键数目为1.5NA | |
| D. | 16.9g过氧化钡(BaO2)固体中阴、阳离子总数为0.3NA |
| A. | Na 和O2 | B. | NaOH和CO2 | C. | S和O2 | D. | AlCl3和NaOH |
| A. | 常温常压下,32 g O3含有的氧原子数目为2 NA | |
| B. | 56 g的Fe与足量的稀盐酸完全反应转移电子数为3NA | |
| C. | 0.1 mol•L-1Na2SO4溶液含有的钠离子数目为0.2 NA | |
| D. | 标准状况下,22.4 L 四氯化碳(CCl4)含有的碳原子数目为NA |
 数十年来,化学工作者对碳的氧化物和氢化物做了广泛深入的研究并取得了一些
数十年来,化学工作者对碳的氧化物和氢化物做了广泛深入的研究并取得了一些 .
. 甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.工业生产甲醇的常用方法是CO(g)+2H2(g)═CH3OH(g)△H<0.
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.工业生产甲醇的常用方法是CO(g)+2H2(g)═CH3OH(g)△H<0.