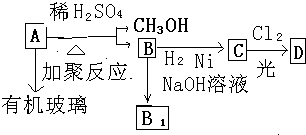
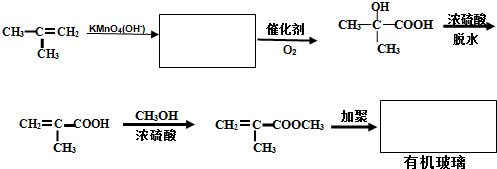
题目内容
11.设NA为阿伏加德罗常数的值,下列有关说法正确的是( )| A. | 在标准状况下,NA个SO2分子所占的体积约为22.4L | |
| B. | 在标准状况下,1L庚烷(C7H16)完全燃烧生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| C. | 7gCnH2n中含有的共价键数目为1.5NA | |
| D. | 16.9g过氧化钡(BaO2)固体中阴、阳离子总数为0.3NA |
分析 A、NA个二氧化硫分子的物质的量为1mol;
B、标况下庚烷为液体;
C、求出CnH2n的物质的量,然后根据1molCnH2n中含(3n-1)mol共价键来分析;
D、求出过氧化钡的物质的量,然后根据1mol过氧化钡中含1mol钡离子和1mol过氧根来分析.
解答 解:A、NA个二氧化硫分子的物质的量为1mol,故在标况下的体积为22.4L,故A正确;
B、标况下庚烷为液体,故不能根据气体摩尔体积来计算其物质的量和分子数,故B错误;
C、7gCnH2n的物质的量为n=$\frac{7g}{14ng/mol}$=$\frac{1}{2n}mol$,而1molCnH2n中含(3n-1)mol共价键,故$\frac{1}{2n}$mol中含$\frac{3n-1}{2n}$mol共价键即$\frac{(3n-1){N}_{A}}{2n}$条,故C错误;
D、16.9g过氧化钡的物质的量为0.1mol,而1mol过氧化钡中含1mol钡离子和1mol过氧根,故0.1mol过氧化钡中含0.2mol离子即0.2NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
1.取3.38g K2CO3和KHCO3的混合物溶于水配成25mL溶液,往溶液中加入25mL Ba(OH)2溶液恰好使生成白色沉淀的量最多.反应后溶液的c(OH-)=0.8mol/L(忽略混合后溶液体积变化).则原混合物中K2CO3和KHCO3 物质的量之比为( )
| A. | 1:2 | B. | 1:1 | C. | 2:1 | D. | 2:3 |
6.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 常温常压下,1.06gNa2CO3含有Na2CO3分子数为0.01NA个 | |
| B. | 标准状况下,22.4LCCl4含有的分子数为1NA个 | |
| C. | 通常状况下,NA个CO2分子占有的体积为22.4L | |
| D. | 0.5mol/L的MgCl2溶液和1mol/L的NaCl溶液中所含Cl-的物质的量浓度相等 |
16. 常温下,向某浓度的草酸(H2C2O4)溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量的分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
常温下,向某浓度的草酸(H2C2O4)溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量的分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
 常温下,向某浓度的草酸(H2C2O4)溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量的分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
常温下,向某浓度的草酸(H2C2O4)溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量的分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )| A. | 从上图分析知草酸氢钾溶液中存在3个平衡 | |
| B. | 常温下:H2C2O4的Ka1=10-1.2、Ka2=10-4.2 | |
| C. | 图中任意一点都有:c(K+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) | |
| D. | 滴定过程中水的电路程度:点(1.2,0.5)<点(4.2,0.5) |
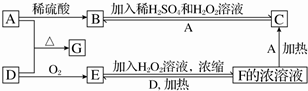
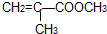 不溶于水,并可以发生以下变化:
不溶于水,并可以发生以下变化: