题目内容
在托盘天平的两盘各盛放等质量烧杯,烧杯内装有足量的等质量、等浓度的稀硫酸,左杯中投入一块镁、右杯中投入与镁等质量的铜铝合金,当反应完成后,天平仍保持平衡,则铜铝合金中铜与铝的质量比为 .
考点:有关混合物反应的计算
专题:计算题
分析:稀硫酸质量相等,加入金属的质量相等,反应后太平仍然保持平衡,则两侧托盘中质量增重相等,令Mg的质量为24g,根据方程式计算质量差,令Al的质量为x,再根据2Al+3H2SO4═Al2(SO4)3+3H2↑,表示出生成氢气质量,利用增重列方程计算Al的质量,进而计算Cu的质量,以此解答.
解答:
解:令Mg的质量为24g,则:
Mg+H2SO4═MgSO4+H2↑ 质量增重
24 2 22
24g 22g
设Al的质量为x,则:
2Al+3H2SO4═Al2(SO4)3+3H2↑
54 6
x
x
故24g-
x=22g,解得x=18g,
故Cu的质量=24g-18g=6g,
该合金中铜与铝的质量比=6g:18g=1:3,
故答案为:1:3.
Mg+H2SO4═MgSO4+H2↑ 质量增重
24 2 22
24g 22g
设Al的质量为x,则:
2Al+3H2SO4═Al2(SO4)3+3H2↑
54 6
x
| 1 |
| 9 |
故24g-
| 1 |
| 9 |
故Cu的质量=24g-18g=6g,
该合金中铜与铝的质量比=6g:18g=1:3,
故答案为:1:3.
点评:本题考查混合物计算,为高频考点,明确两侧托盘中质量增重相等是关键,注意赋值法与差量法的应用,简化计算步骤,难度中等.

练习册系列答案
相关题目
某同学根据苯和四氯化碳互溶、苯的密度比水小、四氯化碳的密度比水大的性质制作了“液体积木”.在试管中注入四氯化碳,再加少量水,再小心加入少量苯,溶液可出现分三层的现象,然后再用漏斗向水层中加入少量胆矾溶液及少量碘水.下列说法正确的是( )
| A、不振荡,静置后上中下三层的颜色分别为无色、蓝色、紫色 |
| B、不振荡,静置后上中下三层的颜色分别为紫色、蓝色、紫色 |
| C、振荡,静置后溶液分为两层,水在下层 |
| D、振荡,静置后溶液仍分为三层 |
 饱和氯水与石灰石反应是制取较浓HClO溶液的方法之一.某兴趣小组进行了如下实验探究:
饱和氯水与石灰石反应是制取较浓HClO溶液的方法之一.某兴趣小组进行了如下实验探究:①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水(如图所示),充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现滤液比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;第二份与稀盐酸混合,立即产生大量无色气体;第三份滤液加热,看到滤液变浑浊且有大量无色气体产生.经检测,上述实验中产生的无色气体均为CO2.依据上述实验可推知:滤液中的溶质除CaCl2、HClO外,还有( )
| A、Ca(ClO)2 |
| B、CaCO3 |
| C、Ca(HCO3)2 |
| D、CaO |
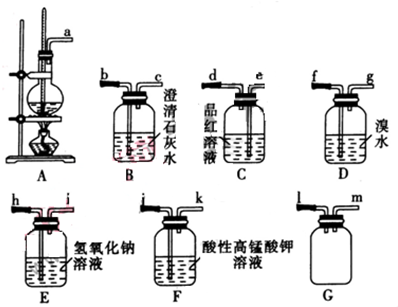
 已知:N2O4(g)=2NO2(g);△H=+57.20kJ?mol-1.
已知:N2O4(g)=2NO2(g);△H=+57.20kJ?mol-1. 有A、B两种有机液体的混合物,如果A、B互溶,且相互不发生化学反应,在常压下,A的沸点为35℃,B的沸点为200℃,回答下列各问:
有A、B两种有机液体的混合物,如果A、B互溶,且相互不发生化学反应,在常压下,A的沸点为35℃,B的沸点为200℃,回答下列各问: