题目内容
17.下列离子或分子能够在指定的分散系中大量共存的是( )| A. | c(H+)=10-13mol/L的溶液中:NO3-、S2O32-、K+、Na+ | |
| B. | 酸性高锰酸钾溶液中:Na+、C2O42-、CH3COO -、NH4+ | |
| C. | 澄清石灰水中:HCO3-、Ba2+、Cl-、NO3- | |
| D. | 空气中:SO2、NO、N2、NH3 |
分析 A.c(H+)=10-13mol/L的溶液为碱性溶液,四种离子之间不反应,都不与氢氧根离子反应;
B.酸性高锰酸钾溶液能够氧化草酸根离子、醋酸根离子;
C.碳酸氢根离子与氢氧化钙反应;
D.NO与空气中氧气反应生成二氧化氮.
解答 解:A.c(H+)=10-13mol/L的溶液中存在大量氢氧根离子,NO3-、S2O32-、K+、Na+之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故A正确;
B.酸性高锰酸钾溶液具有强氧化性,能够氧化C2O42-、CH3COO-,在溶液中不能大量共存,故B错误;
C.澄清石灰水中含有氢氧化钙,HCO3-与氢氧化钙反应,在溶液中不能大量共存,故C错误;
D.NO与氧气反应,在空气中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案
相关题目
7.某溶液能溶解Al(OH)3,则此溶液中一定能大量共存的离子组是( )
| A. | Mg2+、Cl-、Na+、NO3- | B. | K+、Na+、NO3-、HCO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Na+、Cl-、AlO2-、SO42- |
8.下列关于化学的认识不正确的是( )
| A. | 化学是在原子、分子水平上研究物质的组成、结构、性质、制备等的自然科学 | |
| B. | 化学是一门具有创造性的科学,可以利用化学知识创造出自然界中不存在的物质 | |
| C. | 化学的发展经过了从宏观到微观,从感性到理性的逐步深化的过程 | |
| D. | 随着化学的发展,人们最终会实现通过化学变化使水变油的梦想 |
5.我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
I.已知:2CO(g)+O2(g)═2CO2(g),△H=-566kJ•mol-1
2Fe(s)+$\frac{3}{2}$O2(g)═Fe2O3(s),△H=-825.5kJ•mol-1
反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g),△H=-23.5 kJ•mol-1.
Ⅱ.反应 $\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=60%.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d.
a.提高反应温度 b.增大反应体系的压强 c.选取合适的催化剂 d.及时吸收或移出部分CO2 e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题: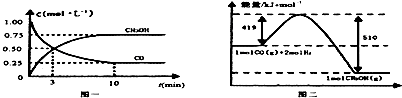
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min).
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如表:
则下列关系正确的是ADE.
A c1=c2B.2Q1=Q3 C.2α1=α3 D.α1+α2=1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2))kJ热量
(3)若在一体积可变的密闭容器中充入l molCO、2molH2和1molCH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向正(填“正”、“逆”)反应方向移动.
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式CH3OH-6e-+8OH-=CO32-+6H2O.
I.已知:2CO(g)+O2(g)═2CO2(g),△H=-566kJ•mol-1
2Fe(s)+$\frac{3}{2}$O2(g)═Fe2O3(s),△H=-825.5kJ•mol-1
反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g),△H=-23.5 kJ•mol-1.
Ⅱ.反应 $\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=60%.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d.
a.提高反应温度 b.增大反应体系的压强 c.选取合适的催化剂 d.及时吸收或移出部分CO2 e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题:

(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min).
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如表:
则下列关系正确的是ADE.
| 容器 | 反应物投入的量 | 反应物的 转化率 | CH3OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
E.该反应若生成1mol CH3OH,则放出(Q1+Q2))kJ热量
(3)若在一体积可变的密闭容器中充入l molCO、2molH2和1molCH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向正(填“正”、“逆”)反应方向移动.
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式CH3OH-6e-+8OH-=CO32-+6H2O.
2.下列各说法中,正确的是( )
| A. | △H>0表示放热反应,△H<0表示吸热反应 | |
| B. | 热化学方程式中的化学计量数只表示物质的量,可以是分数也可以是小数 | |
| C. | 1molH2SO4和1mo Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 | |
| D. | 1molH2和0.5mol O2反应放出的热就是H2的燃烧热 |
9.下列说法正确的是( )
| A. | 治疗胃酸过多,可用NaHCO3,不能用Al(OH)3,因其含有Al元素 | |
| B. | Al箔用砂纸打磨后,在空气中受热可以熔化,由于氧化膜被破坏,熔化的Al可以滴落 | |
| C. | 用铂丝做焰色反应实验,每次做完后都需要用盐酸洗涤,再灼烧至跟酒精灯火焰颜色相同后再使用 | |
| D. | 实验室制备Al(OH)3时,氨水不宜过量,因为Al(OH)3与过量的浓氨水反应生成NH4AlO2 |
6.C(s)+H2O(g)?CO(g)+H2(g);△H=+131.3KJ/mol.它表示( )
| A. | 1mol固态焦炭与1mol水蒸气反应产生1mol一氧化碳和1mol氢气,吸收131.3 kJ的热量 | |
| B. | 碳与水反应吸收131.3 kJ的热量 | |
| C. | 1mol碳和1mol水反应吸收131.3 kJ的热量 | |
| D. | 固态碳和气态水各1mol反应,放出131.3 kJ的热量 |
