题目内容
X、Y、Z、W分别代表四种不同的短周期元素.X元素的原子最外层电子排布为ns1,Y元素的原子价电子排布为ns2np2,Z元素的最外层电子数是其电子层数的3倍,W元素原子的M能层的p能级有3个电子.
(1)Z原子的基态电子排布图为 ;
(2)当n=2时,元素Y在周期表中的位置是 ,属于 区元素,X离子的结构示意图为 ;
(3)当n=3时,单质X在单质Z中燃烧产物的电子式为 ,1molYZ2中含有共价键为 mol,X、Y、Z、W四种元素的电负性由大到小的顺序是 (用元素符号表示).
(1)Z原子的基态电子排布图为
(2)当n=2时,元素Y在周期表中的位置是
(3)当n=3时,单质X在单质Z中燃烧产物的电子式为
考点:位置结构性质的相互关系应用,元素电离能、电负性的含义及应用
专题:
分析:X、Y、Z、W分别代表四种不同的短周期元素.x元素的原子最外层电子排布为ns1,x位于ⅠA族;Y元素的原子价电子排布为ns2np2,Y位于ⅣA族;Z元素的最外层电子数是其电子层数的3倍,则Z元素原子有2个电子层,最外层电子数为6,故Z为氧元素;W元素原子的M电子层的P能级中有3个电子,则W元素原子电子排布式为1s22s22p63s23p3,故W为P元素,据此解答各小题即可.
解答:
解:X、Y、Z、W分别代表四种不同的短周期元素.x元素的原子最外层电子排布为ns1,x位于ⅠA族;Y元素的原子价电子排布为ns2np2,Y位于ⅣA族;Z元素的最外层电子数是其电子层数的3倍,则Z元素原子有2个电子层,最外层电子数为6,故Z为氧元素;W元素原子的M电子层的P能级中有3个电子,则W元素原子电子排布式为1s22s22p63s23p3,故W为P元素,
(1)Z为氧元素,Z原子的基态电子排布图为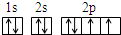 ,故答案为:
,故答案为: ;
;
(2)当n=2时,Y为碳元素,在周期表中的位置是 二周期第ⅣA族,属于p 区元素,X为锂元素,锂离子的结构示意图为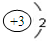 ,
,
故答案为:二周期第ⅣA族;p;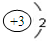 ;
;
(3)当n=3时,X为钠元素,Y为硅元素,钠在氧气中燃烧产物为过氧化钠,过氧化钠的电子式为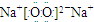 ,由于在SiO2中,每个硅原子周围有4个Si-O键,所以1molSiO2中含有共价键为4mol,在元素周期表中,同周期元素从左向右,电负性逐渐增大,同周期元素从上向下,电负性逐渐减小,所以Na、Si、O、P四种元素的电负性由大到小的顺序是O>P>Si>Na,
,由于在SiO2中,每个硅原子周围有4个Si-O键,所以1molSiO2中含有共价键为4mol,在元素周期表中,同周期元素从左向右,电负性逐渐增大,同周期元素从上向下,电负性逐渐减小,所以Na、Si、O、P四种元素的电负性由大到小的顺序是O>P>Si>Na,
故答案为: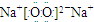 ;4;O>P>Si>Na.
;4;O>P>Si>Na.
(1)Z为氧元素,Z原子的基态电子排布图为
 ,故答案为:
,故答案为: ;
;(2)当n=2时,Y为碳元素,在周期表中的位置是 二周期第ⅣA族,属于p 区元素,X为锂元素,锂离子的结构示意图为
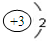 ,
,故答案为:二周期第ⅣA族;p;
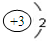 ;
;(3)当n=3时,X为钠元素,Y为硅元素,钠在氧气中燃烧产物为过氧化钠,过氧化钠的电子式为
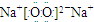 ,由于在SiO2中,每个硅原子周围有4个Si-O键,所以1molSiO2中含有共价键为4mol,在元素周期表中,同周期元素从左向右,电负性逐渐增大,同周期元素从上向下,电负性逐渐减小,所以Na、Si、O、P四种元素的电负性由大到小的顺序是O>P>Si>Na,
,由于在SiO2中,每个硅原子周围有4个Si-O键,所以1molSiO2中含有共价键为4mol,在元素周期表中,同周期元素从左向右,电负性逐渐增大,同周期元素从上向下,电负性逐渐减小,所以Na、Si、O、P四种元素的电负性由大到小的顺序是O>P>Si>Na,故答案为:
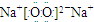 ;4;O>P>Si>Na.
;4;O>P>Si>Na.
点评:本题考查结构性质位置关系,涉及电子排布图、原子结构示意图、电子式、元素周期律等,难度中等,注意基础知识的理解掌握.

练习册系列答案
相关题目
短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )
| X | ||
| Y | ||
| Z |
| A、X最外层电子数为2,处在ⅡA族 |
| B、Y的单质与氢气化合很容易 |
| C、Y的最高正价为+7,最低负价为-1 |
| D、Z是活泼的金属元素 |
有机物X(C4H6O5)广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内为多,该化合物具有如下性质:
(1)1molX与足量的金属钠反应产生1.5mol气体
(2)X与醇或羧酸在浓H2SO4和加热的条件下均生成有香味的产物
(3)X在一定程度下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应
根据上述信息,对X的结构判断正确的是( )
(1)1molX与足量的金属钠反应产生1.5mol气体
(2)X与醇或羧酸在浓H2SO4和加热的条件下均生成有香味的产物
(3)X在一定程度下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应
根据上述信息,对X的结构判断正确的是( )
| A、X中肯定有碳碳双键 |
| B、X中可能有三个羟基和一个 一COOR官能团 |
| C、X中可能有两个羧基和一个羟基 |
| D、X中可能有三个羧基 |
某探究小组在某温度下测定溶液的pH时发现:0.01mol?L-1的氢氧化钠溶液中,由水电离出的c(H+)=10-11mol?L-1,则该小组在该温度下测得0.1mol?L-1氢氧化钠溶液的pH应为( )
| A、13 | B、12 | C、11 | D、10 |
人们使用四百万只象鼻虫和它们的215磅粪物,历经30多年时间弄清了棉子象鼻虫的四种信息素的组成,它们的结构可表示如图:

图中四种信息素中互为同分异构体的是( )

图中四种信息素中互为同分异构体的是( )
| A、①和② | B、①和③ |
| C、③和④ | D、②和④ |

 有X、Y、Z三种元素,已知X、Y是元素周期表前20号元素,且X的原子序数比Y大4,元素Z形成的金属单质在日常生活中应用最广泛.请回答:
有X、Y、Z三种元素,已知X、Y是元素周期表前20号元素,且X的原子序数比Y大4,元素Z形成的金属单质在日常生活中应用最广泛.请回答: