题目内容
五种短周期元素A、B、C、D、E,A原子的最外层电子数是次外层的3倍;B是第三周期中除稀有气体外原子半径最大的元素;B和D能形成BD型离子化合物,且B、D的原子核外电子层数相同;C和D能形成CD3的化合物;C原子比E原子多1个电子;1.8g C与足量的稀H2SO4反应,所产生的氢气在标准状况下的体积为2.24L;C原子中质子数比中子数少1.则:
(1)元素A在周期表中的位置
(2)D与E形成的化合物的电子式
(3)A、B、D简单离子的半径大小关系 (用离子符号表示)
(4)C单质溶于B的最高价氧化物的水化物的离子方程式 .
(1)元素A在周期表中的位置
(2)D与E形成的化合物的电子式
(3)A、B、D简单离子的半径大小关系
(4)C单质溶于B的最高价氧化物的水化物的离子方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:五种短周期元素A、B、C、D、E,A原子的最外层电子数是次外层的3倍,则A为氧元素;B是第三周期中除稀有气体外原子半径最大的元素,则B为钠元素;B和D能形成BD型离子化合物,且B、D的原子核外电子层数相同,则D为氯元素;C和D能形成CD3的化合物,则C显+3价;C原子比E原子多1个电子;1.8g C与足量的稀H2SO4反应,所产生的氢气在标准状况下的体积为2.24L,设C的相对原子质量M,则有
=
,所以C的相对原子质量为27;C原子中质子数比中子数少1,所以C为铝元素,C原子比E原子多1个电子,则E为镁元素,据此答题.
| ||
| 2 |
| 2.24 |
| 22.4 |
解答:
解:五种短周期元素A、B、C、D、E,A原子的最外层电子数是次外层的3倍,则A为氧元素;B是第三周期中除稀有气体外原子半径最大的元素,则B为钠元素;B和D能形成BD型离子化合物,且B、D的原子核外电子层数相同,则D为氯元素;C和D能形成CD3的化合物,则C显+3价;C原子比E原子多1个电子;1.8g C与足量的稀H2SO4反应,所产生的氢气在标准状况下的体积为2.24L,设C的相对原子质量M,则有
=
,所以C的相对原子质量为27;C原子中质子数比中子数少1,所以C为铝元素,C原子比E原子多1个电子,则E为镁元素,
(1)A为氧元素,元素A在周期表中的位置是第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)D与E形成的化合物为氯化镁,其电子式为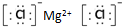 ,故答案为:
,故答案为: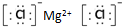 ;
;
(3)电子层数越多,离子半径越大,电子层数相同时,核电荷数越多,半径越小,所以A、B、D简单离子的半径大小关系为Cl->O2->Na+,
故答案为:Cl->O2->Na+;
(4)铝溶于氢氧化钠溶液的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
| ||
| 2 |
| 2.24 |
| 22.4 |
(1)A为氧元素,元素A在周期表中的位置是第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)D与E形成的化合物为氯化镁,其电子式为
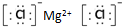 ,故答案为:
,故答案为: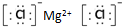 ;
; (3)电子层数越多,离子半径越大,电子层数相同时,核电荷数越多,半径越小,所以A、B、D简单离子的半径大小关系为Cl->O2->Na+,
故答案为:Cl->O2->Na+;
(4)铝溶于氢氧化钠溶液的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评:本题考查结构性质位置关系应用,题目难度中等,推断元素是解题关键,涉及元素周期表、电子式、离子半径比较、离子方程式的书写等知识,注意掌握元素周期表结构、元素周期律内容.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
可逆反应2NO2?2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n mol NO2
②用NO2、NO、O2的物质的量浓度变化表示的反应速率的.比为2:2:1的状态
③混合气体的颜色不再改变的状态
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态.
①单位时间内生成n molO2的同时生成2n mol NO2
②用NO2、NO、O2的物质的量浓度变化表示的反应速率的.比为2:2:1的状态
③混合气体的颜色不再改变的状态
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态.
| A、①③⑤ | B、②③⑤ |
| C、①③④ | D、①②③④⑤ |
某研究性学习小组借助如图所示的仪器装置完成收集NO气体的实验.正确的操作是( )


| A、从①口进气,用排水法集气 |
| B、从①口进气,用排气法集气 |
| C、从②口进气,用排水法集气 |
| D、从②口进气,用排气法集气 |
将0.1mol/L的下列物质的水溶液加热至80℃,溶液的pH不变的是( )
| A、NaCl |
| B、NaOH |
| C、H2SO4 |
| D、NH4Cl |

 在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,第二周期元素B原子的核外成对电子数是未成对电子数的2倍,C原子的最外层p轨道的电子为半充满结构,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.
在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,第二周期元素B原子的核外成对电子数是未成对电子数的2倍,C原子的最外层p轨道的电子为半充满结构,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.
