题目内容
有机物A俗名乳酸.A最早发现于酸牛奶中,它是人体内糖类代谢的中间体,可由马铃薯、玉米淀粉等发酵制得,A的钙盐是人们喜爱的补钙剂之一.A在某种催化剂的存在下进行氧化,其产物不能发生银镜反应.在浓硫酸存在下,A可发生如图所示的反应.试写出:
(1)反应类型:A→E ,A→F .
(2)A中官能团名称:
(3)化学方程式:
①A→E ,
②A→F .
③乳酸聚合成聚乳酸 .
④E在一定条件下发生加聚反应生成高分子化合物的化学方程式: .
(4)用乳酸聚合的纤维(聚乳酸)非常适合于做手术缝合线,尤其是做人体内部器官手术的缝合线,试发现其中的原因
(5)乳酸缩聚产物可以替代生产目前因造成“白色污染”而被停止使用的餐具原料.由其缩聚产物所产生的塑料在乳酸菌的作用下能迅速分解为无毒物质,可以降解,不致于造成严重的“白色污染”.下列有关这种替代的降解塑料的叙述正确的是
A、其相对分子质量为72
B、其生产过程中聚合方式与聚苯乙烯相似
C、它属于一种线型高分子材料
D、降解塑料是一种纯净物.

(1)反应类型:A→E
(2)A中官能团名称:
(3)化学方程式:
①A→E
②A→F
③乳酸聚合成聚乳酸
④E在一定条件下发生加聚反应生成高分子化合物的化学方程式:
(4)用乳酸聚合的纤维(聚乳酸)非常适合于做手术缝合线,尤其是做人体内部器官手术的缝合线,试发现其中的原因
(5)乳酸缩聚产物可以替代生产目前因造成“白色污染”而被停止使用的餐具原料.由其缩聚产物所产生的塑料在乳酸菌的作用下能迅速分解为无毒物质,可以降解,不致于造成严重的“白色污染”.下列有关这种替代的降解塑料的叙述正确的是
A、其相对分子质量为72
B、其生产过程中聚合方式与聚苯乙烯相似
C、它属于一种线型高分子材料
D、降解塑料是一种纯净物.
考点:有机物的推断
专题:有机物的化学性质及推断
分析:A在浓硫酸存在下既能和乙醇反应,又能和乙酸反应,说明A中既有羧基又有羟基.A催化氧化的产物不能发生银镜反应,说明羟基不在碳链的端点上,可判断A为乳酸CH3CH(OH)COOH,而A被氧化可得CH3COCHO,不能发生银镜反应,这就进一步证明了A是乳酸.A与乙醇发生酯化反应生成B,B为CH3CH(OH)COOCH2CH3,A与乙酸发生酯化反应生成D,D为CH3COOCH(CH3)COOH,A在浓硫酸、加热条件下生成E,E可以溴水褪色,应发生消去反应,E为CH2=CHCOOH,A在浓硫酸、加热条件下生成六原子环状化合物F,结合F的分子式可知,为2分子乳酸发生酯化反应生成环状化合物,故F为 ,以此解答该题.
,以此解答该题.
 ,以此解答该题.
,以此解答该题.解答:
解:A在浓硫酸存在下既能和乙醇反应,又能和乙酸反应,说明A中既有羧基又有羟基.A催化氧化的产物不能发生银镜反应,说明羟基不在碳链的端点上,可判断A为乳酸CH3CH(OH)COOH,而A被氧化可得CH3COCHO,不能发生银镜反应,这就进一步证明了A是乳酸.A与乙醇发生酯化反应生成B,B为CH3CH(OH)COOCH2CH3,A与乙酸发生酯化反应生成D,D为CH3COOCH(CH3)COOH,A在浓硫酸、加热条件下生成E,E可以溴水褪色,应发生消去反应,E为CH2=CHCOOH,A在浓硫酸、加热条件下生成六原子环状化合物F,结合F的分子式可知,为2分子乳酸发生酯化反应生成环状化合物,故F为 ,
,
(1)A→E是乳酸在浓硫酸、加热条件下发生消去反应生成CH2=CHCOOH,A→F是乳酸在浓硫酸、加热条件下发生酯化反应生成环状化合物,
故答案为:消去反应;酯化反应;
(2)A为CH3CH(OH)COOH,含有羟基、羧基,故答案为:羟基、羧基;
(3)A→E是乳酸在浓硫酸、加热条件下发生消去反应生成CH2=CHCOOH,反应方程式为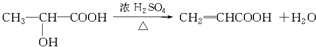 ,
,
A→F是乳酸在浓硫酸、加热条件下发生酯化反应生成环状化合物 ,反应方程式为
,反应方程式为
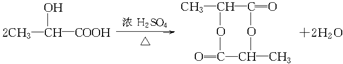 ,
,
乳酸中含有醇羟基和羧基,所以在一定条件下,乳酸能发生缩聚反应生成高聚物,反应方程式为 ,
,
E为CH2=CHCOOH,含有碳碳双键,可发生加聚反应,方程式为 ,
,
故答案为: ;
; ;
; ;
; ;
;
(4)聚乳酸非常适合于做手术缝合线,可在体内微生物作用下会分解生成二氧化碳和水,故答案为:乳酸在体内微生物作用下会分解生成二氧化碳和水;
(5)A.聚乳酸为高分子化合物,其相对分子质量为72n,故A错误;
B.聚乳酸发生缩聚反应生成,而聚苯乙烯为加聚产物,故B错误;
C.聚乳酸为缩聚产物,属于一种线型高分子材料,故C正确;
D.降解塑料为高聚物,n值不确定,是一种混合物,故D错误.
故选C.
 ,
,(1)A→E是乳酸在浓硫酸、加热条件下发生消去反应生成CH2=CHCOOH,A→F是乳酸在浓硫酸、加热条件下发生酯化反应生成环状化合物,
故答案为:消去反应;酯化反应;
(2)A为CH3CH(OH)COOH,含有羟基、羧基,故答案为:羟基、羧基;
(3)A→E是乳酸在浓硫酸、加热条件下发生消去反应生成CH2=CHCOOH,反应方程式为
 ,
,A→F是乳酸在浓硫酸、加热条件下发生酯化反应生成环状化合物
 ,反应方程式为
,反应方程式为 ,
,乳酸中含有醇羟基和羧基,所以在一定条件下,乳酸能发生缩聚反应生成高聚物,反应方程式为
 ,
,E为CH2=CHCOOH,含有碳碳双键,可发生加聚反应,方程式为
 ,
,故答案为:
 ;
; ;
; ;
; ;
;(4)聚乳酸非常适合于做手术缝合线,可在体内微生物作用下会分解生成二氧化碳和水,故答案为:乳酸在体内微生物作用下会分解生成二氧化碳和水;
(5)A.聚乳酸为高分子化合物,其相对分子质量为72n,故A错误;
B.聚乳酸发生缩聚反应生成,而聚苯乙烯为加聚产物,故B错误;
C.聚乳酸为缩聚产物,属于一种线型高分子材料,故C正确;
D.降解塑料为高聚物,n值不确定,是一种混合物,故D错误.
故选C.
点评:本题是框图型有机推断题,难度不大,其突破口是化合物A,从题干中的隐含信息及框图中的反应关系确定A为乳酸,进而推断其它物质,是对有机化学知识的综合考查,能较好的考查学生的分析、思维能力.

练习册系列答案
相关题目




 ,合成路线是
,合成路线是

 +RCl→
+RCl→ +NaCl
+NaCl
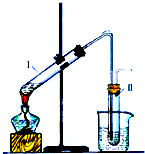 如图是实验室制取溴乙烷的装置示意图,烧杯中装有自来水,试管I和试管II中均事先装有少量蒸馏水.请回答下列问题:
如图是实验室制取溴乙烷的装置示意图,烧杯中装有自来水,试管I和试管II中均事先装有少量蒸馏水.请回答下列问题: