题目内容
5.两份等质量的铜片,一份直接与足量的质量分数为98.0%的浓硫酸(密度为1.84g•cm-3)反应,另一份先制成氧化铜,再与足量的稀硫酸反应.结果两种方法得到的硫酸铜质量相等,消耗两酸的体积也相等.求浓、稀硫酸的物质的量浓度.分析 根据c=$\frac{1000ρw}{M}$,计算浓硫酸的物质的量浓度,先求消耗浓H2SO4的体积:Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O,1.00mol Cu消耗H2SO4的物质的量为2.00mol,其质量为:m(H2SO4)=98g•mol-1×2.00mol=196g,所以1.00mol Cu消耗浓H2SO4的体积为:$\frac{196g}{1.84g•c{m}^{-3}×98%}$=108.7mL;而与稀硫酸反应,
发生2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;CuO+H2SO4(稀)═CuSO4+H2O,可知Cu与H2SO4(稀)的关系式为:
Cu~H2SO4,相当于1.00mol Cu消耗1.00mol H2SO4(稀),由于所耗浓、稀H2SO4的体积相等,所以稀H2SO4的浓度为:
c(稀Η2SO4)=$\frac{1.00mol}{0.108\;7L}$=9.20mol•L-1,由此解答.
解答 解:c(浓硫酸)=$\frac{1000ρw}{M}$=$\frac{1000×1.84×98%}{98}$=18.4mol•L-1,消耗浓H2SO4的体积:Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O,1.00mol Cu消耗H2SO4的物质的量为2.00mol,其质量为:m(H2SO4)=98g•mol-1×2.00mol=196g,所以1.00mol Cu消耗浓H2SO4的体积为:$\frac{196g}{1.84g•c{m}^{-3}×98%}$=108.7mL;而与稀硫酸反应,
发生2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;CuO+H2SO4(稀)═CuSO4+H2O,可知Cu与H2SO4(稀)的关系式为:Cu~H2SO4,相当于1.00mol Cu消耗1.00mol H2SO4(稀),由于消耗两酸的体积也相等,所以稀H2SO4的浓度为:c(稀Η2SO4)=$\frac{1.00mol}{0.108\;7L}$=9.20mol•L-1,
答:浓、稀硫酸的物质的量浓度分别为:c(浓H2SO4)=18.4mol•L-1,c(稀H2SO4)=9.20mol•L-1.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度与溶质质量分数的关系为解答关键,试题培养了学生的化学计算能力.

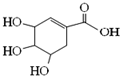
| A. | 分子式为C7H6O5 | |
| B. | 分子中的碳原子都在同一平面 | |
| C. | 可发生加成和取代反应 | |
| D. | 在水溶液中羟基和羧基均能电离出氢离子 |
| A. | SO2 | B. | O2 | C. | NH3 | D. | HCl |
| A. | 10与12 | B. | 8与17 | C. | 19与17 | D. | 6与14 |
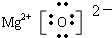 ;
; .
.