题目内容
 化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题:
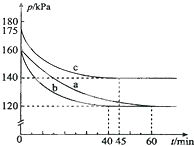
化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题:反应AX3(g)+X2(g)?AX5(g)在容积为10L的密闭容器中进行.起始时AX3和X2均为0.2mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.
①列式计算实验a从反应开始至达到平衡时的反应速率 v(AX3)=
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由小到大的次序为
③与实验a相比,其他两组改变的实验条件及判断依据是:b
④用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为
考点:化学平衡的计算
专题:
分析:①根据v=
概念公式计算出反应速率;
②根据到达平衡用时的多少可以比较出反应速率的大小;
③根据图象中的曲线的变化趋势判断出改变的实验条件及判断依据;
④对于气体来讲,压强之比就等于物质的量之比,根据化学平衡三段式,进而求得转化率的表达式及具体的值.
| △c |
| △t |
②根据到达平衡用时的多少可以比较出反应速率的大小;
③根据图象中的曲线的变化趋势判断出改变的实验条件及判断依据;
④对于气体来讲,压强之比就等于物质的量之比,根据化学平衡三段式,进而求得转化率的表达式及具体的值.
解答:
解:①起始时AX3和X2均为0.2mol,即no=0.4mol,总压强为160KPa,平衡时总压强为120KPa,根据压强之比等于物质的量之比,平衡时总物质的量为n=0.30mol,
AX3(g)+X2(g)?AX5(g)
初始 (mol) 0.20 0.20 0
变化(mol) x x x
平衡 (mol) 0.20-x 0.20-x x
(0.20-x)+(0.20-x)+x=0.30
解得:x=0.10
a从反应开始至达到平衡时的反应速率 v(AX3)=
=1.7×10-4mol/(L?min),
故答案为:1.7×10-4mol/(L?min);
②根据到abc达平衡用时的多少可以比较出反应速率由小到大的次序为:a<c<b,故答案为:a<c<b;
③与实验a相比,b实验到达平衡的时间变小,但平衡没有发生移动,所以为使用催化剂;c实验到达平衡时总压强变大,说明平衡逆向移动,而化学反应速率变大,考虑到该反应是放热反应,所以是升高温度所导致的;
故答案为:加入催化剂,反应速率加快,但平衡点没有改变;温度升高,反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大;
④用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,根据压强之比等于物质的量之比有:
=
,n=0.4×
,
AX3(g)+X2(g)?AX5(g)
初始 (mol) 0.20 0.20 0
变化(mol) x x x
平衡 (mol) 0.20-x 0.20-x x
(0.20-x)+(0.20-x)+x=n
x=0.40-n=0.4-0.4×
Α=
=2(1-
).
故答案为:2(1-
).
AX3(g)+X2(g)?AX5(g)
初始 (mol) 0.20 0.20 0
变化(mol) x x x
平衡 (mol) 0.20-x 0.20-x x
(0.20-x)+(0.20-x)+x=0.30
解得:x=0.10
a从反应开始至达到平衡时的反应速率 v(AX3)=
| 0.1mol |
| 10L×60min |
故答案为:1.7×10-4mol/(L?min);
②根据到abc达平衡用时的多少可以比较出反应速率由小到大的次序为:a<c<b,故答案为:a<c<b;
③与实验a相比,b实验到达平衡的时间变小,但平衡没有发生移动,所以为使用催化剂;c实验到达平衡时总压强变大,说明平衡逆向移动,而化学反应速率变大,考虑到该反应是放热反应,所以是升高温度所导致的;
故答案为:加入催化剂,反应速率加快,但平衡点没有改变;温度升高,反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大;
④用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,根据压强之比等于物质的量之比有:
| p0 |
| p |
| 0.4 |
| n |
| p |
| p0 |
AX3(g)+X2(g)?AX5(g)
初始 (mol) 0.20 0.20 0
变化(mol) x x x
平衡 (mol) 0.20-x 0.20-x x
(0.20-x)+(0.20-x)+x=n
x=0.40-n=0.4-0.4×
| p |
| p0 |
Α=
0.4-0.4×
| ||
| 0.2 |
| p |
| p0 |
故答案为:2(1-
| p |
| p0 |
点评:本题考查了化学反应速率、转化率的计算、影响化学反应速率和化学平衡的因素等内容,关键是理解压强与物质的量的关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
把一定量的Na2O2和NaHCO3的混合粉末分为两等份,将其中一份加入到100mL稀盐酸中恰好完全反应,生成的气体干燥后体积为2.24L(标况);再将此气体通入另一份混合物中,恰好完全反应后,得到O2 2.016L(标况),则加入稀盐酸的物质的量浓度是( )
| A、3.4mol/L |
| B、0.2mol/L |
| C、1.8mol/L |
| D、3.6mol/L |
实验室制取氧气的反应为 2KClO3
2KCl+3O2↑,反应后从剩余物中回收二氧化锰的操作顺序正确的是(已知MnO2为黑色难溶于水的固体)( )
| ||
| △ |
| A、溶解、蒸发、洗涤、过滤 |
| B、溶解、过滤、蒸发、洗涤 |
| C、溶解、过滤、洗涤、干燥 |
| D、溶解、洗涤、过滤、加热 |
 A、B、C、D、E为短周期元素,且原子序数依次递增.其中B元素形成化合物种类最多,A、E同主族.A与 E的质子数之和是B质子数的2倍,且E与D分别形成的最简单离子都含有10个电子.由以上元素组成的物质BD和C2具有相同的电子数.
A、B、C、D、E为短周期元素,且原子序数依次递增.其中B元素形成化合物种类最多,A、E同主族.A与 E的质子数之和是B质子数的2倍,且E与D分别形成的最简单离子都含有10个电子.由以上元素组成的物质BD和C2具有相同的电子数.