题目内容
把一定量的Na2O2和NaHCO3的混合粉末分为两等份,将其中一份加入到100mL稀盐酸中恰好完全反应,生成的气体干燥后体积为2.24L(标况);再将此气体通入另一份混合物中,恰好完全反应后,得到O2 2.016L(标况),则加入稀盐酸的物质的量浓度是( )
| A、3.4mol/L |
| B、0.2mol/L |
| C、1.8mol/L |
| D、3.6mol/L |
考点:有关混合物反应的计算
专题:
分析:第一份发生反应①2Na2O2+4HCl=4NaCl+2H2O+O2↑、②NaHCO3+HCl=NaCl+H2O+CO2↑,生成气体为O2与CO2;
将第一份生成的干燥气体,通入第二份Na2O2的NaHCO3的混合粉末,发生反应2Na2O2+2CO2=2Na2CO3+O2,根据气体物质的量差量利用差量法计算参加反应的二氧化碳的物质的量,从而计算出第一份中生成二氧化碳、氧气的物质的量,再根据反应方程式计算出反应消耗的HCl总的物质的量,最后根据c=
计算出盐酸的浓度.
将第一份生成的干燥气体,通入第二份Na2O2的NaHCO3的混合粉末,发生反应2Na2O2+2CO2=2Na2CO3+O2,根据气体物质的量差量利用差量法计算参加反应的二氧化碳的物质的量,从而计算出第一份中生成二氧化碳、氧气的物质的量,再根据反应方程式计算出反应消耗的HCl总的物质的量,最后根据c=
| n |
| V |
解答:
解:标况下2.24L混合气体的物质的量为:
=0.1mol,
2.016LO2的物质的量为:n(O2)=
=0.09mol,则:
2Na2O2+2CO2=2Na2CO3+O2 气体物质的量减小△n
2 2 1
n(CO2) 0.1mol-0.09mol=0.01mol
所以:n(CO2)=
=0.02mol,
由于恰好完全反应,则第一份生成的CO2与混合物中含有的过氧化钠反应,第一份生成CO2的为0.02mol,生成的O2为:0.1mol-0.02mol=0.08mol,则:
2Na2O2+4HCl=4NaCl+2H2O+O2↑
0.32mol 0.08mol
NaHCO3+HCl=NaCl+H2O+CO2↑
0.02mol 0.02mol
所以消耗的HCl的物质的量为:0.32mol+0.02mol=0.34mol,其物质的量浓度为:
=3.4mol/L,
故选A.
| 2.24L |
| 22.4L/mol |
2.016LO2的物质的量为:n(O2)=
| 2.016L |
| 22.4L/mol |
2Na2O2+2CO2=2Na2CO3+O2 气体物质的量减小△n
2 2 1
n(CO2) 0.1mol-0.09mol=0.01mol
所以:n(CO2)=
| 0.01mol×2 |
| 1 |
由于恰好完全反应,则第一份生成的CO2与混合物中含有的过氧化钠反应,第一份生成CO2的为0.02mol,生成的O2为:0.1mol-0.02mol=0.08mol,则:
2Na2O2+4HCl=4NaCl+2H2O+O2↑
0.32mol 0.08mol
NaHCO3+HCl=NaCl+H2O+CO2↑
0.02mol 0.02mol
所以消耗的HCl的物质的量为:0.32mol+0.02mol=0.34mol,其物质的量浓度为:
| 0.34mol |
| 0.1L |
故选A.
点评:本题考查混合物反应的计算,题目难度中等,注意明确差量法在化学计算中的应用,正确分析题干信息并明确反应原理为解答本题的关键,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
现有三组溶液:①汽油和水 ②酒精和水 ③氯化钠的水溶液.分离以上各混合液的正确方法依次是( )
| A、分液、萃取、蒸馏 |
| B、萃取、蒸馏、分液 |
| C、分液、蒸馏、蒸发 |
| D、蒸馏、萃取、分液 |
 将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )
将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )| A、原合金质量为0.92g |
| B、标准状况下产生氢气896mL |
| C、图中V2为60mL |
| D、图中m值为1.56g |
 一定条件下,将一定量的A、B、C、D四种物质,置于密闭容器中发生如下反应:mA(s)+nB(g)?pC(g)+q(D)g.达到平衡后,测得B的浓度为0.5mol/L.保持温度不变,将密闭容器的容积扩大到原来的两倍,再次达到平衡后,测得B的浓度为0.2mol/L.当其条件不变时,C在反应混合物中的体积分数(x)与温度(T)、时间(t)的关系如图所示,下列叙述正确的是( )
一定条件下,将一定量的A、B、C、D四种物质,置于密闭容器中发生如下反应:mA(s)+nB(g)?pC(g)+q(D)g.达到平衡后,测得B的浓度为0.5mol/L.保持温度不变,将密闭容器的容积扩大到原来的两倍,再次达到平衡后,测得B的浓度为0.2mol/L.当其条件不变时,C在反应混合物中的体积分数(x)与温度(T)、时间(t)的关系如图所示,下列叙述正确的是( )| A、容积扩大到原来的两倍,平衡向逆反应方向移动 |
| B、化学方程式中n>p+q |
| C、达到平衡后,若升高温度,平衡向逆反应方向移动 |
| D、达到平衡后,增加A的量,有利于提高B的转化率 |

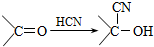

 ):
):
 化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题:
化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题: 原子序数依次增大的X、Y、Z、M、N五种元素,XZ2是引起温室效应的主要气体,M
原子序数依次增大的X、Y、Z、M、N五种元素,XZ2是引起温室效应的主要气体,M