题目内容
 A、B、C、D、E为短周期元素,且原子序数依次递增.其中B元素形成化合物种类最多,A、E同主族.A与 E的质子数之和是B质子数的2倍,且E与D分别形成的最简单离子都含有10个电子.由以上元素组成的物质BD和C2具有相同的电子数.
A、B、C、D、E为短周期元素,且原子序数依次递增.其中B元素形成化合物种类最多,A、E同主族.A与 E的质子数之和是B质子数的2倍,且E与D分别形成的最简单离子都含有10个电子.由以上元素组成的物质BD和C2具有相同的电子数.请回答以下问题:
(1)E在周期表中的位置为
(2)由A、D、E三种元素形成的化合物是一种很重要的化工原料,该化合物的电子式为
(3)由A、B组成的化合物M的产量可以用来衡量一个国家的石油化工生产水平,则化合物M分子空间构型是
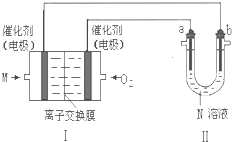
图Ⅰ是M燃料电池(电解质为KOH溶液)的结构示意图,请回答:
①Ⅰ中负极的电极反应式是
②若在Ⅱ中实现锌片上镀铜,则b的电极材料是
③若在Ⅱ中实现Cu+H2SO4=CuSO4+H2↑,则a的电极反应式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E为短周期元素,且原子序数依次递增,B元素形成化合物种类最多,则B为C元素;
A、E同主族,A与E的质子数之和是B质子数的2倍,B质子数的2倍是12,根据原子序数相对大小知A是H元素、C是Na元素;
E与D分别形成的最简单离子都含有10个电子,由以上元素组成的物质BD和C2具有相同的电子数,则C是N元素、D是O元素;
(1)E是Na元素,钠原子核外有3个电子层,最外层有1个电子,据此判断E在周期表中的位置;
(2)由A、D、E三种元素形成的化合物是一种很重要的化工原料,则为NaOH,NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键;
(3)由A、B组成的化合物M的产量可以用来衡量一个国家的石油化工生产水平,则M为乙烯,为空间平面型结构;
14g该化合物M燃烧,产物是气体时,放出的热为705.5kJ,即0.5mol乙烯完全燃烧生成二氧化碳和水蒸气时放出705.5kJ热量,则1mol乙烯燃烧生成二氧化碳和水蒸气时放出1411.0kJ热量,据此书写其热化学反应方程式;
①该燃料电池中,负极上乙烯失电子和氢氧根离子反应生成碳酸根离子和水;
②电镀时,镀层作阳极、镀件作阴极,电解质为含有阳极材料的可溶性盐;
③若在Ⅱ中实现Cu+H2SO4=CuSO4+H2↑,则Cu作阳极,阳极上Cu失电子发生氧化反应.
A、E同主族,A与E的质子数之和是B质子数的2倍,B质子数的2倍是12,根据原子序数相对大小知A是H元素、C是Na元素;
E与D分别形成的最简单离子都含有10个电子,由以上元素组成的物质BD和C2具有相同的电子数,则C是N元素、D是O元素;
(1)E是Na元素,钠原子核外有3个电子层,最外层有1个电子,据此判断E在周期表中的位置;
(2)由A、D、E三种元素形成的化合物是一种很重要的化工原料,则为NaOH,NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键;
(3)由A、B组成的化合物M的产量可以用来衡量一个国家的石油化工生产水平,则M为乙烯,为空间平面型结构;
14g该化合物M燃烧,产物是气体时,放出的热为705.5kJ,即0.5mol乙烯完全燃烧生成二氧化碳和水蒸气时放出705.5kJ热量,则1mol乙烯燃烧生成二氧化碳和水蒸气时放出1411.0kJ热量,据此书写其热化学反应方程式;
①该燃料电池中,负极上乙烯失电子和氢氧根离子反应生成碳酸根离子和水;
②电镀时,镀层作阳极、镀件作阴极,电解质为含有阳极材料的可溶性盐;
③若在Ⅱ中实现Cu+H2SO4=CuSO4+H2↑,则Cu作阳极,阳极上Cu失电子发生氧化反应.
解答:
解:A、B、C、D、E为短周期元素,且原子序数依次递增,B元素形成化合物种类最多,则B为C元素;
A、E同主族,A与E的质子数之和是B质子数的2倍,B质子数的2倍是12,根据原子序数相对大小知A是H元素、C是Na元素;
E与D分别形成的最简单离子都含有10个电子,由以上元素组成的物质BD和C2具有相同的电子数,则C是N元素、D是O元素;
(1)E是Na元素,钠原子核外有3个电子层,最外层有1个电子,所以Na位于第三周期第IA族,故答案为:第3周期ⅠA族;
(2)由A、D、E三种元素形成的化合物是一种很重要的化工原料,则为NaOH,NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键,其电子式为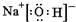 ,故答案为:
,故答案为: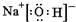 ;
;
(3)由A、B组成的化合物M的产量可以用来衡量一个国家的石油化工生产水平,则M为乙烯,为空间平面型结构;
14g该化合物M燃烧,产物是气体时,放出的热为705.5kJ,即0.5mol乙烯完全燃烧生成二氧化碳和水蒸气时放出705.5kJ热量,则1mol乙烯燃烧生成二氧化碳和水蒸气时放出1411.0kJ热量,其热化学方程式为C2H4(g)+3O2(g)=2CO2(g)+2H2O(g)△H=-1411.0kJ?mol-1;
故答案为:平面;C2H4(g)+3O2(g)=2CO2(g)+2H2O(g)△H=-1411.0kJ?mol-1;
①该燃料电池中,负极上乙烯失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为C2H4-12e-+16OH-=2CO32-+10H2O,故答案为:C2H4-12e-+16OH-=2CO32-+10H2O;
②电镀时,镀层作阳极、镀件作阴极,电解质为含有阳极材料的可溶性盐,a为阳极、b为阴极,所以b为镀件锌,硫酸铜溶液为电解质溶液,故答案为:锌;CuSO4溶液;
③若在Ⅱ中实现Cu+H2SO4=CuSO4+H2↑,则Cu作阳极,阳极上Cu失电子发生氧化反应,电极反应式为Cu-2e-=Cu2+,故答案为:Cu-2e-=Cu2+.
A、E同主族,A与E的质子数之和是B质子数的2倍,B质子数的2倍是12,根据原子序数相对大小知A是H元素、C是Na元素;
E与D分别形成的最简单离子都含有10个电子,由以上元素组成的物质BD和C2具有相同的电子数,则C是N元素、D是O元素;
(1)E是Na元素,钠原子核外有3个电子层,最外层有1个电子,所以Na位于第三周期第IA族,故答案为:第3周期ⅠA族;
(2)由A、D、E三种元素形成的化合物是一种很重要的化工原料,则为NaOH,NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键,其电子式为
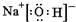 ,故答案为:
,故答案为: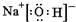 ;
;(3)由A、B组成的化合物M的产量可以用来衡量一个国家的石油化工生产水平,则M为乙烯,为空间平面型结构;
14g该化合物M燃烧,产物是气体时,放出的热为705.5kJ,即0.5mol乙烯完全燃烧生成二氧化碳和水蒸气时放出705.5kJ热量,则1mol乙烯燃烧生成二氧化碳和水蒸气时放出1411.0kJ热量,其热化学方程式为C2H4(g)+3O2(g)=2CO2(g)+2H2O(g)△H=-1411.0kJ?mol-1;
故答案为:平面;C2H4(g)+3O2(g)=2CO2(g)+2H2O(g)△H=-1411.0kJ?mol-1;
①该燃料电池中,负极上乙烯失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为C2H4-12e-+16OH-=2CO32-+10H2O,故答案为:C2H4-12e-+16OH-=2CO32-+10H2O;
②电镀时,镀层作阳极、镀件作阴极,电解质为含有阳极材料的可溶性盐,a为阳极、b为阴极,所以b为镀件锌,硫酸铜溶液为电解质溶液,故答案为:锌;CuSO4溶液;
③若在Ⅱ中实现Cu+H2SO4=CuSO4+H2↑,则Cu作阳极,阳极上Cu失电子发生氧化反应,电极反应式为Cu-2e-=Cu2+,故答案为:Cu-2e-=Cu2+.
点评:本题考查位置结构性质的相互关系及应用,涉及原电池和电解池原理、热化学反应、化学用语等知识点,侧重考查学生对基本概念、基本理论的理解和运用,难点是燃料电池电极反应式的书写,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列依据相关实验得出的结论正确的是( )
| A、向某溶液中加入稀盐酸,产生能使石灰水变浑浊的气体,该溶液一定含有CO32- |
| B、向某溶液中滴加氯水后,滴加KSCN溶液,溶液呈红色,该溶液中一定含有Fe2+ |
| C、向某溶液中加入氯化钡溶液,产生不溶于稀盐酸白色沉淀,该溶液一定含有SO42- |
| D、往某溶液中加入NaOH,微热,产生能使湿润的红色石蕊试纸变蓝的气体,该溶液中一定含有NH4+ |

 有A、B、C、D、E、F六种短周期元素,其元素特征信息如表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如表: 化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题:
化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题: