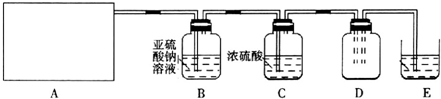
题目内容
20℃时,11.6g由CO2和H2O组成的混合气体与足量的Na2O2充分反应,固体质量增加3.6g,则原混合气体的平均摩尔质量为(g/mol)( )
| A、5.8 | B、11.6 |
| C、23.2 | D、46.4 |
考点:钠的重要化合物,有关混合物反应的计算
专题:计算题
分析:200℃时水为气态,向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应方程式为:2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,固体只增加了3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,根据n=
计算生成氧气的物质的量,根据方程式可知n(混合气体)=2n(O2),进而计算原混合气体的平均摩尔质量.
| n |
| M |
解答:
解:200℃时水为气态,向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应方程式为:2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,固体只增加了3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,氧气的物质的量为:n(O2)=
=0.25mol,
根据方程式2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑可知:n(混合气体)=2n(O2)=2×0.25mol=0.5mol,
所以原混合气体的平均摩尔质量为:
=23.2g/mol,
故选C.
| 8g |
| 32g/mol |
根据方程式2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑可知:n(混合气体)=2n(O2)=2×0.25mol=0.5mol,
所以原混合气体的平均摩尔质量为:
| 11.6g |
| 0.5mol |
故选C.
点评:本题考查有关混合物反应的计算、过氧化钠的性质等,题目难度中等,明确固体质量变化的原因是解答本题的关键,注意掌握根据化学反应进行的化学计算的方法.

练习册系列答案
相关题目
下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
| A、将NaHCO3固体加入新制氯水中,有无色气泡(H+) |
| B、使红色布条退色(HCl) |
| C、向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈红色(Cl2) |
| D、滴加AgNO3溶液生成白色沉淀(Cl-) |
某无色透明的强酸性溶液中,能大量共存的一组离子是( )
| A、K+、Na+、AlO2-、SO42- |
| B、Mg2+、Al3+、NO3-、SO42- |
| C、Na+、K+、SO42-、MnO4- |
| D、NH4+、Na+、HCO3-、NO3- |
图Ⅰ、Ⅱ分别是甲、乙两组同学将反应AsO43-+2I-+2H+═AsO33-+I2+H2O设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40% NaOH溶液.下列叙述中正确的是( )
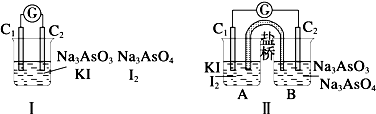

| A、甲组操作时,电流计(G)指针发生偏转 |
| B、乙组操作时,C1上发生的电极反应为 I2+2e-═2I- |
| C、甲组操作时,溶液颜色变浅 |
| D、乙组操作时,C2做正极 |
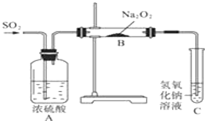 有两个实验小组探究Na2O2与SO2的反应,都用如图所示装置进行实验.
有两个实验小组探究Na2O2与SO2的反应,都用如图所示装置进行实验.