题目内容
钢轨的野外焊接可用铝热反应.下列对铝热反应中电子转移方向和数目的表示正确的是( )
A、 |
B、 |
C、 |
D、 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:该铝热反应方程式为2Al+Fe2O3
Al2O3+2Fe,该反应中Al元素化合价由0价变为+3价、Fe元素化合价由+3价变为0价,据此分析解答.
| ||
解答:
解:该铝热反应方程式为2Al+Fe2O3
Al2O3+2Fe,该反应中Al元素化合价由0价变为+3价、Fe元素化合价由+3价变为0价,所以Al失电子、Fe元素得电子,该方程式中转移电子数为6,该反应中电子转移方向和数目为 ,故选C.
,故选C.
| ||
 ,故选C.
,故选C.
点评:本题考查了氧化还原反应,明确元素化合价变化即可解答,知道常见元素化合价,会正确运用双线桥和单线桥表示电子转移方向和数目,为学习难点.

练习册系列答案
相关题目
2.24g铁屑与30mL 2mol/L盐酸充分反应后,溶液中FeCl2的物质的量是( )
| A、0.02 mol |
| B、0.03 mol |
| C、0.04mol |
| D、0.06 mol |
下列各组中化合物的性质比较,不正确的是( )
| A、半径N>O>F |
| B、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C、稳定性:PH3>H2S>HCl |
| D、酸性:HClO4>H2SO4>H2CO3 |
已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1 H2(g)+
O2(g)═H2O(l)△H=-285.8kJ?mol-1由此可知,在等温下蒸发45g液态水需吸收的热量( )
| 1 |
| 2 |
| A、483.6 kJ |
| B、110 kJ |
| C、285.8 kJ |
| D、221 kJ |
下列解释过程或事实的方程式不正确的是( )
| A、0.01 mol/L CH3COOH的pH>2:CH3COO-+H2O?CH3COOH+OH- |
| B、用Fecl3溶液腐蚀印刷电路板上的铜:2Fe3++Cu═2Fe2++Cu2+ |
| C、盛装NaOH溶液试剂瓶不能用玻璃塞:2OH-+SiO2═SiO32-+H2O |
| D、自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的方铅矿(PbS),慢慢转变为铜蓝(CuS):CuSO4+PbS═CuS+PbSO4 |
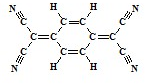 目前,世界上已合成了几百种有机超导体,TCNQ是其中之一.TCNQ的分子结构如图所示.下列关于TCNQ说法错误的为( )
目前,世界上已合成了几百种有机超导体,TCNQ是其中之一.TCNQ的分子结构如图所示.下列关于TCNQ说法错误的为( )| A、分子中所有的氮原子在同一平面内 |
| B、属于芳香族化合物 |
| C、能发生加聚反应 |
| D、该物质难溶于水 |
在离子RO3n-中,共有X个核外电子,R原子的质量数为A,则R原子核内含有的质子数目是( )
| A、A-X+n+48 |
| B、A-X+n+24 |
| C、A-X-n-24 |
| D、X-n-24 |
下列物质即能发生消去反应也能发生氧化反应氧化为羧酸的是( )
| A、CH3CH2CH2OH |
| B、CH3OH |
| C、(CH3)2CHOH |
| D、(CH3)3COH |