题目内容
15.甲醇是一种重要的可再生能源.(1)已知2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=a kJ/mol
CO(g)+2H2(g)=CH3OH(g)△H=b kJ/mol
试写出由CH4和O2制取甲醇的热化学方程式:2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b)kJ/mol.
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g)?CH3OH(g).
甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况.从反应开始到达平衡,用H2表示平均反应速率υ(H2)=0.15mol/(L•min).
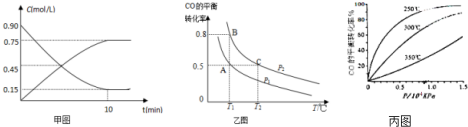
(3)在一容积可变的密闭容器中充入10mol CO和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示.
①下列说法能够判断该反应达到化学平衡状态的是BCD.
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中混合气体的密度不再改变
D.体系中气体的平均摩尔质量不再改变
②A、B、C三点化学反应速率由大到小顺序是υ(C)>υ(B)>υ(A).
(4)CO在不同温度下的平衡转化率与压强的关系如图丙所示.该反应的逆反应△H<0(填“>”或“<”).实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低.
分析 (1)利用盖斯定律,1式加2式的二倍即可得到该方程式及焓变;
(2)根据反应速率v=$\frac{△c}{△t}$,结合物质表示的反应速率之比等于物质前边的系数之比来计算;
(3)①平衡标志是正逆反应速率相同,各成分浓度保持不变分析判断选项;
②正反应方向为气体体积减小的方向,T1℃时比较CO的转化率,转化率越大,则压强越大;
(4)从横坐标上一点,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越低转化率越低,说明,升温时平衡向逆向移动.
解答 解:(1)已知①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=a KJ/mol
②CO(g)+2H2(g)=CH3OH(g)△H=b KJ/mol,①+②×2可得到2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b)kJ/mol,故答案为:2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b)kJ/mol;
(2)用甲醇表示的反应速率v=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min),氢气表示的反应速率是甲醇的2倍,即0.15mol/(L•min),故答案为:0.15mol/(L•min);
(3)①A.H2的消耗速率等于CH3OH的生成速率的2倍,不能说明正逆反应速率相等,不一定平衡,故A错误;
B.H2的体积分数不再改变是化学平衡的特征,达到了平衡,故B正确;
C.体系中混合气体的密度不再改变,说明气体的物质的量不变反应达平衡状态,故C正确;
D.体系中气体的平均摩尔质量等于质量和物质的量的比值,物质的量变化,质量不变,所以当体系中气体的平均摩尔质量不再改变,证明达到了平衡,故D正确.
故选BCD;
②正反应方向为气体体积减小的方向,T1℃时比较CO的转化率,转化率越大,则压强越大,图象中PB转化率大于PA,可知PA<PB,温度越高反应速率越快,压强越大反应速率越快,所以υ(C)>υ(B)>υ(A),故答案为:υ(C)>υ(B)>υ(A);
(4)从横坐标上一点0.5处,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越高转化率越低,说明,升温时平衡向逆向移动.
第二问:实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是工业生产要考虑速经济效益,要考虑速度和效率,压强越大需要的条件越高,花费越大.
故答案为:<;在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低.
点评 本题考查了学生的识图能力,学会定一议二法分析图象得方法,这是学生必备的能力,题目难度中等.

| A. | 用火柴点燃酒精灯 | |
| B. | 熄灭酒精灯火焰时,用灯帽盖灭 | |
| C. | 用酒精灯外焰给物质加热 | |
| D. | 用燃着的酒精灯去点燃另一盏酒精灯 |
| A. | 漂白粉是混合物,有效成分是Ca(ClO)2 | |
| B. | 光照氯水有气泡逸出,该气体是Cl2 | |
| C. | Cl2能使湿润的有色布条褪色,说明Cl2具有漂白性 | |
| D. | 实验室用二氧化锰与稀盐酸反应制取Cl2 |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将某溶液与稀盐酸反应产生的气体通入澄清石灰水 | 石灰水变浑浊 | 该溶液中一定含有CO32- |
| B | 常温下,将铁片浸入足量浓硫酸中 | 铁片不溶解 | 常温下,铁与浓硫酸一定没有发生化学反应 |
| C | 向某食盐溶液中滴加淀粉溶液 | 溶液颜色不变 | 该食盐中一定没有添加KIO3 |
| D | 向苯酚钠溶液中滴加乙酸溶液 | 溶液变浑浊 | 相同条件下,乙酸的酸性一定比苯酚强 |
| A. | A | B. | B | C. | C | D. | D |
| 物质 | 熔点/℃ | 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 |
| 甲 | -98 | 57.7 | 0.93 | 可溶 |
| 乙 | -84 | 77 | 0.90 | 可溶 |
| A. | 萃取法 | B. | 过滤法 | C. | 蒸馏法 | D. | 分液法 |
| A. | CuSO4只是还原剂 | |
| B. | Cu3P既是氧化产物又是还原产物 | |
| C. | P既是氧化剂又是还原剂 | |
| D. | 若有11 mol P参加反应,转移电子的物质的量为60 mol |