题目内容
8.金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )| A. | 阳极发生还原反应 | |
| B. | 电解后,电解槽底部的阳极泥中只有Cu和Pt | |
| C. | 电解过程中,阳极质量的减少与阴极质量的增加相等 | |
| D. | 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ |
分析 A、阳极失去电子发生氧化反应;
B、粗镍中含有少量Fe、Zn、Cu、Pt等杂质做阳极,铜和鉑不失电子沉降电解池底部形成阳极泥;
C、阳极失电子的有Fe、Zn、Cu;阴极析出的是铜;依据电子守恒计算分析;
D、精炼过程中,电解质溶液中一定含有Ni2+.
解答 解:A、阳极发生氧化反应,其电极反应式:Ni-2e-=Ni2+,Fe-2e-=Fe2+;Zn-2e-=Zn2+,故A错误;
B、粗镍中含有少量Fe、Zn、Cu、Pt等杂质做阳极,铜和铂不失电子沉降电解池底部形成阳极泥,电解后,电解槽底部的阳极泥中有Cu和Pt,故B正确;
C、电解过程中阳极失电子的有Fe、Zn;阴极析出的是镍;依据电子守恒,阳极质量的减少与阴极质量的增加不相等,故C错误;
D、电解后,溶液中存在的阳离子有H+、Fe2+、Zn2+、Ni2+,故D错误;
故选B.
点评 本题考查了电解原理的应用,主要考查电解精炼镍的原理分析判断,题目难度中等.

练习册系列答案
相关题目
18.下列关于元素周期表的叙述正确的是( )
| A. | 周期表中有八个主族,八个副族 | |
| B. | 目前使用的元素周期表中,最长的周期含有32种元素 | |
| C. | 短周期元素是指1-20号元素 | |
| D. | 原子的最外层电子数都等于该元素所在的族序数 |
19.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致.图为N2(g)和O2(g)生成NO(g)过程中的能量变化

下列说法中正确的是( )

下列说法中正确的是( )
| A. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ | |
| B. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| C. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
3.用聚光手电筒照射下列分散系,不能观察到丁达尔效应的是( )
| A. | 淀粉溶液 | B. | Fe(OH)3胶体 | C. | 鸡蛋清溶液 | D. | 葡萄糖溶液 |
13.从柑橘中炼制的萜二烯其结构简式为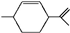 .有关萜二烯的说法不正确的是( )
.有关萜二烯的说法不正确的是( )
 .有关萜二烯的说法不正确的是( )
.有关萜二烯的说法不正确的是( )| A. | 萜二烯的分子式为C10H16,不属于芳香烃 | |
| B. | 可溶于乙醇或乙醚,不溶于水 | |
| C. | 萜二烯分子中所有碳原子处于同一个平面上 | |
| D. | 萜二烯与过量的溴的四氯化碳溶液反应后的产物为 |
20.下列与胶体的有关性质的描述错误的是( )
| A. | 将盐卤或石膏加入豆浆,制成美味可口的豆腐 | |
| B. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀,即可制得Fe(OH)3胶体 | |
| C. | 放电影时,放映室射到屏幕上的光柱 | |
| D. | 在盛有红褐色Fe(OH)3胶体的U形管两端加上直流电压后,阴极附近颜色逐渐加深 |
17.下列各组物质中,都是强电解质的是( )
| A. | HBr、HCl、BaSO4 | B. | NH4Cl、CH3COONa、Na2S | ||
| C. | NaOH、Ca(OH)2、NH3•H2O | D. | HClO、NaF、Ba(OH)2 |
18.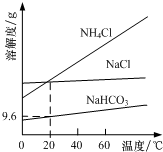 以NaCl、CO2、NH3为原料发生反应,制得NaHCO3和NH4Cl是“侯氏制碱法”的重要步骤.相关物质的溶解度曲线如图所示.下列说法不正确的是( )
以NaCl、CO2、NH3为原料发生反应,制得NaHCO3和NH4Cl是“侯氏制碱法”的重要步骤.相关物质的溶解度曲线如图所示.下列说法不正确的是( )
 以NaCl、CO2、NH3为原料发生反应,制得NaHCO3和NH4Cl是“侯氏制碱法”的重要步骤.相关物质的溶解度曲线如图所示.下列说法不正确的是( )
以NaCl、CO2、NH3为原料发生反应,制得NaHCO3和NH4Cl是“侯氏制碱法”的重要步骤.相关物质的溶解度曲线如图所示.下列说法不正确的是( )| A. | 将NaHCO3加热分解可得纯碱 | |
| B. | 常温下碳酸氢钠的溶解度大于碳酸钠 | |
| C. | 采用蒸发结晶从溶液中分离出NaHCO3 | |
| D. | 20℃时,NaHCO3饱和溶液的物质的量浓度约为1.1mol/L |