题目内容
19.如何用所提供的试剂除杂(括号内的物质为杂质),将所选答案序号填入相应的空格内.(1)供选择的试剂、方法:A、还原性铁粉 B、新制氯水 C、NaOH溶液 D、稀盐酸 E、加热| 欲提纯物质与杂质 | 所选试剂 |
| Fe (Al) | |
| Al2O3(Al) | |
| FeCl2 (FeCl3) | |
| FeCl3 (FeCl2) | |
| SiO2 (CaCO3) |
(3)在400mL2mol•L-1 Ba(OH)2溶液中,溶质的物质的量是0.8mol.此溶液中OH-的物质的量浓度为4mol•L-1,Ba2+的物质的量浓度为2mol•L-1.
分析 (1)铝可与NaOH溶液反应而铁与氢氧化钠不反应;铝氧化成氧化铝;FeCl3具有氧化性,能与还原性铁粉反应生成FeCl2;FeCl2具有还原性,被氯气氧化成氯化铁;SiO2不与酸反应等物质的性质进行分离.
(2)根据n=$\frac{N}{{N}_{A}}$计算出氨气分子的物质的量,然后根据氨气的分子式计算出含有氢离子的物质的量;
(3)根据n=cV,氢氧化钡是二元强碱,氢氧根离子的浓度是氢氧化钡的2倍,钡离子的浓度等于氢氧化钡的浓度;
解答 解:(1)Fe 中含有Al,加入NaOH溶液;Al2O3中含杂质Al,用加热的方法将铝转化为氧化铝;FeCl2 中含杂质FeCl3,加入还原性铁粉,将铁离子还原成亚铁;FeCl3 中含杂质FeCl2,加新制氯水将亚铁氧化成铁离子;SiO2 中含有CaCO3,加盐酸将碳酸钙转化为氯化钙溶液,故答案为:
| 欲提纯物质与杂质 | 所选试剂 |
| Fe (Al) | C |
| Al2O3(Al) | E |
| FeCl2 (FeCl3) | A |
| FeCl3 (FeCl2) | B |
| SiO2 (CaCO3) | D |
(2)9.03×1023个氨分子含氨气分子的物质的量为:$\frac{9.03×1{0}^{23}}{6.02×1{0}^{23}}$=1.5mol,1.5mol氨气分子中含有氢离子的物质的量为:1.5mol×3=4.5mol,
故答案为:1.5;4.5;
(3)n=cV=400mL×10-3L/mL×2mol•L-1=0.8mol;溶液中OH-的物质的量浓度为 4mol•L-1;Ba2+的物质的量浓度为2mol•L-1,故答案为:0.8mol;4;2.
点评 本题综合考查物质的分离以及药品的储存等知识,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.如图实验装置、试剂选用或操作正确的是( )
| A. |  用水吸收氨气 | B. |  除去CO2中含有的少量HCl | ||
| C. |  稀释浓硫酸 | D. |  海带灼烧成灰 |
4.KNO3固体中混有Ba(NO3)2,现欲得到纯净的KNO3固体,下列措施合理的是( )
| A. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}SO_{4}溶液}$$\stackrel{蒸发结晶}{→}$KNO3固体 | |
| B. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}CO_{3}溶液}$$\stackrel{过滤}{→}$滤液$\stackrel{蒸发结晶}{→}$KNO3固体 | |
| C. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}CO_{3}溶液}$$\stackrel{过滤}{→}$滤液$→_{足量}^{HNO_{3}溶液}$$\stackrel{蒸发结晶}{→}$KNO3固体 | |
| D. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}SO_{4}溶液}$$\stackrel{过滤}{→}$滤液$→_{足量}^{HNO_{3}溶液}$$\stackrel{蒸发结晶}{→}$KNO3固体 |
11.下列正确的是( )
| A. | 1molH2燃烧放出的热量为H2的燃烧热 | |
| B. |  和 和 互为同系物 互为同系物 | |
| C. | Na2SO3和H2O2的反应为氧化还原反应 | |
| D. | BaSO4的水溶液不导电,故BaSO4是弱电解质 |
9.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
| A. | 原子核内有10个中子的氧原子818O | B. | 乙烯的结构简式为:C2H4 | ||
| C. | CH4分子的比例模型: | D. | -CH3(甲基)的电子式为: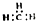 |


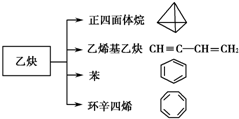 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物. .
. 、
、 .
.