题目内容
7.A、B、C、D、E、H、I均是由短周期元素组成的中学常见物质,B、D、E、G为单质,F是一种常见的金属氧化物.A为氯碱工业的产物之一,B元素是地壳中含量最高的金属元素,C是一种无色无味的液体,D是一种新型能源物质,这些物质的转化关系如下(反应条件已略去,反应物与生成物都已保留在图中).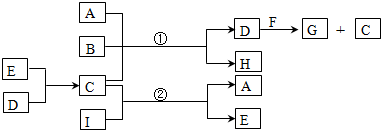
请回答下列问题:
(1)A中所含化学键的名称为离子键、共价键;物质I的电子式为
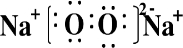 .
.(2)写出②的离子反应方程式2Na2O2+2H2O═4Na++4OH-+O2↑.
(3)若G为实验室中常用来催化乙醇氧化为乙醛的物质,则F为CuO(写化学式).
(4)若G为第四周期过渡元素,F与B的混合物常用于铁路上焊接铁轨.写出G与C在一定条件下反应的化学方程式3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(5)25°C时,pH均为10的A、H两瓶溶液中,由水电离出来的氢氧根离子浓度之比为1:106.
分析 B元素是地壳中含量最高的金属元素,则B为Al,C是一种无色无味的液体,则C为水,D是一种新型能源物质,D为H2,所以E为O2,A为氯碱工业的产物之一,则A为NaOH,H为NaAlO2,若G为实验室中常用来催化乙醇氧化为乙醛的物质,则F为CuO,G为Cu,若G为第四周期过渡元素,F与B的混合物常用于铁路上焊接铁轨,G为Fe,F为四氧化三铁,由转化中的反应②可知,I为Na2O2,据此解答.
解答 解:B元素是地壳中含量最高的金属元素,则B为Al,C是一种无色无味的液体,则C为水,D是一种新型能源物质,D为H2,所以E为O2,A为氯碱工业的产物之一,则A为NaOH,H为NaAlO2,若G为实验室中常用来催化乙醇氧化为乙醛的物质,则F为CuO,G为Cu,若G为第四周期过渡元素,F与B的混合物常用于铁路上焊接铁轨,G为Fe,F为四氧化三铁,由转化中的反应②可知,I为Na2O2.
(1)A为NaOH,含离子键和共价键,I为Na2O2,其电子式为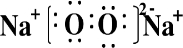 ,
,
故答案为:离子键、共价键;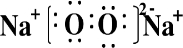 ;
;
(2)反应②的离子反应方程式为:2Na2O2+2H2O═4Na++4OH-+O2↑,
故答案为:2Na2O2+2H2O═4Na++4OH-+O2↑;
(3)若G为实验室中常用来催化乙醇氧化为乙醛的物质,则F为CuO,故答案为:CuO;
(4)若G为第四周期过渡元素,F与B的混合物常用于铁路上焊接铁轨,G为Fe,G与C在一定条件下反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(5)25℃时,pH均为10的NaOH、NaAlO2两瓶溶液中,由水电离出来的氢氧根离子浓度之比为10-10mol/L:10-4mol/L=1:106,故答案为:1:106.
点评 本题考查无机物的推断,B、C为推断的突破口,掌握Al与碱溶液的反应、过氧化钠与水的反应即可推断各物质,侧重元素化合物的性质及相互转化反应的考查,综合性较强,题目难度中等.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案| A. | Cl2 | B. | NH3 | C. | CO2 | D. | FeCl3 |
| A. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010的溶液中:Na+ ${NH}_{4}^{+}$ HCO${\;}_{3}^{-}$ Cl- | |
| B. | 含有大量ClO-的溶液中:K+ OH- Na+ ${SO}_{3}^{2-}$ | |
| C. | c(Al3+)=0.1 mol?L-1的溶液中:Na+ NO${\;}_{3}^{-}$ AlO${\;}_{2}^{-}$ ${SO}_{4}^{2-}$ | |
| D. | 澄清透明的溶液中:Cu2+ Fe3+ NO${\;}_{3}^{-}$ Cl- |
| A. | 能使广泛pH试纸显蓝色的溶液:K+、Na+、CH3COO-、Br- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | 0.1 mol?L-1 FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | 由水电离的c (H+)=1×10-14 mol?L-1的溶液中:Ca2+、K+、Cl-、HCO${\;}_{3}^{-}$ |
| A. | 胶体的本质特征是胶粒直径在1nm~100nm | |
| B. | 丁达尔现象可以用来区别胶体和溶液 | |
| C. | 煮沸饱和FeCl3溶液可以制得Fe(OH)3胶体 | |
| D. | 溶液和胶体的分散质都能通过滤纸孔隙 |
| A. | 质量为16g的O2和O3的混合气体中所含的氧原子的个数为NA | |
| B. | 18 g NH4+含有质子数为10NA | |
| C. | 1 mol过氧化钠与足量水反应时,转移电子的数目为2NA | |
| D. | 0.1 mol•L-1的NaCl溶液中,Na+与Cl-的离子总数为0.2NA |