题目内容
17.NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 质量为16g的O2和O3的混合气体中所含的氧原子的个数为NA | |
| B. | 18 g NH4+含有质子数为10NA | |
| C. | 1 mol过氧化钠与足量水反应时,转移电子的数目为2NA | |
| D. | 0.1 mol•L-1的NaCl溶液中,Na+与Cl-的离子总数为0.2NA |
分析 A.氧气和臭氧均由氧原子构成;
B.1个铵根离子含有11个质子;
C.过氧化钠与水的反应为歧化反应;
D.溶液体积未知.
解答 解:A.氧气和臭氧均由氧原子构成,故16g混合物中含有的氧原子的物质的量n=$\frac{16g}{16g/mol}$=1mol,故为NA个,故A正确;
B.18 g NH4+物质的量为1mol,含有有质子数为11NA,故B错误;
C.过氧化钠与水的反应为歧化反应,1mol过氧化钠与水反应转移1mol电子即NA个,故C错误;
D.溶液体积未知,无法计算微粒个数,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
8.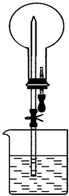 如图所示的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与实验事实不相符的是( )
如图所示的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与实验事实不相符的是( )
 如图所示的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与实验事实不相符的是( )
如图所示的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与实验事实不相符的是( )| A. | SO2(饱和NaHSO3溶液) 无色喷泉 | B. | NH3(H2O含酚酞) 红色喷泉 | ||
| C. | H2S(CuSO4溶液) 黑色喷泉 | D. | HCl(AgNO3溶液) 白色喷泉 |
12.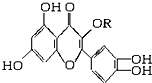 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )| A. | 1 mol该物质可与5 mol NaOH发生反应 | |
| B. | 1 mol该物质与足量浓溴水反应,最多消耗6 mol Br2 | |
| C. | 一定条件下1 mol该物质可与H2加成,消耗H2最大量为6 mol | |
| D. | 维生素P能发生水解反应 |
2.下列特点中,所谓“合金”必须具有的是( )
(1)具有金属特性
(2)通过熔合加工
(3)有两种或两种以上金属(或金属与非金属)
(4)铸造性很好.
(1)具有金属特性
(2)通过熔合加工
(3)有两种或两种以上金属(或金属与非金属)
(4)铸造性很好.
| A. | (1)(2)(3) | B. | (1)(3)(4) | C. | (2)(4) | D. | (1)(4) |
9.在分析某些溶液中的离子成分时,为了排除其他离子可能的干扰,通常先在溶液中加入一些试剂对干扰离子进行掩蔽以得到准确的结果.下列掩蔽方法和分析结果正确的是( )
| A. | 某溶液中滴加KSCN溶液呈无色,再滴加氯水后出现血红色,该溶液中含有Fe2+ | |
| B. | 某溶液中滴加NaOH溶液后再滴加CaCl2溶液出现白色沉淀,该溶液中含有CO32- | |
| C. | 某溶液中滴加氨水后再滴加NaOH溶液出现白色沉淀,该溶液中含有Al3+ | |
| D. | 某溶液中滴加足量稀盐酸后,再滴加BaCl2溶液才出现白色沉淀,该溶液中含有SO42- |
14.下列含有非极性键的离子化合物是( )
| A. | HI | B. | NaOH | C. | MgBr2 | D. | CaC2 |
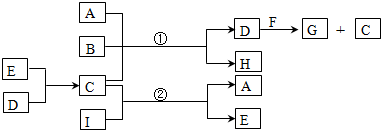
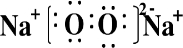 .
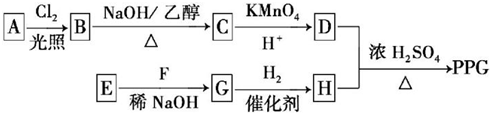
.
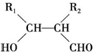 .
. .
. ,反应类型为消去反应.
,反应类型为消去反应. .
. (写结构简式);D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是c(填标号).
(写结构简式);D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是c(填标号).