题目内容
14.下列有关盐类水解的判断正确的是( )| A. | 某盐溶液呈中性,该盐不一定是强酸强碱盐 | |
| B. | 加热所有盐溶液,溶液中离子的浓度都增大 | |
| C. | 稀释盐溶液,水解常数、水解程度和离子浓度都增大 | |
| D. | NaHCO3溶液中只存在2个平衡 |
分析 A.醋酸铵为弱酸弱碱盐,溶液为中性;
B.强酸强碱盐,加热时阴阳离子不变;
C.水解常数只与温度有关;
D.NaHCO3溶液中存在水的电离平衡、碳酸氢根离子的水解平衡及电离平衡.
解答 解:A.醋酸铵为弱酸弱碱盐,溶液为中性,则某盐溶液呈中性,该盐不一定是强酸强碱盐,故A正确;
B.强酸强碱盐,加热时阴阳离子不变,可促进水的电离,故B错误;
C.水解常数只与温度有关,则稀释盐溶液,水解常数不变、水解程度增大,而离子浓度有增大、减小变化,故C错误;
D.NaHCO3溶液中存在水的电离平衡、碳酸氢根离子的水解平衡及电离平衡,平衡多于2个,故D错误;
故选A.
点评 本题考查盐类水解,为高频考点,把握盐的类别、水解规律、平衡移动为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的难点,题目难度不大.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
4.下列说法正确的是( )
| A. |  的一溴代物和 的一溴代物和  的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) | |
| B. | CH3CH=CHCH3分子中的四个碳原子在同一直线上 | |
| C. | 按系统命名法,化合物  的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 | |
| D. |  与 与  都是α-氨基酸且互为同系物 都是α-氨基酸且互为同系物 |
5.下列说法正确的是( )
| A. | 28g N2含有的原子数为NA | |
| B. | 4gCa变成Ca2+失去的电子数为0.1NA | |
| C. | 1molO2的质量等于1mol O的质量 | |
| D. | 24gO2和24gO3所含有的原子数目相等 |
19.下列实验装置设计正确、且能达到目的是( )
| A. |  用于除去CO2中的HCl | B. |  排水法收集NO | ||
| C. |  配制一定物质的量浓度的稀硫酸 | D. |  海水的淡化 |
6.在指定的条件下,下列各组离子一定能大量共存的是( )
| A. | 无色的溶液中:Fe3+、K+、NO3-、Cl- | |
| B. | 含有大量Ba2+的溶液中:NH4+、Na+、Cl-、H+ | |
| C. | pH=13的溶液中:NH4+、Na+、SO42-、Cl- | |
| D. | c(H+)=0.1 mol•L-1的溶液中:K+、I-、Cl-、NO3- |
12.下列除杂试剂的选择和除杂后检验杂质是否除尽的方法均正确的是( )
| 选项 | 物质(括号内为杂质) | 除杂试剂 | 检验方法 |
| A | CO2(SO2) | 饱和NaHSO3溶液 | 将已除杂质的少量气体通入品红溶液 |
| B | NaHCO3溶液(Na2CO3) | 过量CO2 | 取少量溶液,加入Ca (OH)2溶液,观察现象 |
| C | NO(NO2) | 水 | 观察颜色 |
| D | 乙烷(乙烯) | 酸性KMnO4溶液 | 将已除杂质的少量气体通入溴水 |
| A. | A | B. | B | C. | C | D. | D |

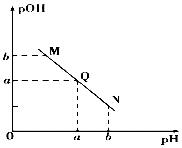 现有①0.1mol/L NaOH溶液和②0.1mol/L HX溶液.
现有①0.1mol/L NaOH溶液和②0.1mol/L HX溶液.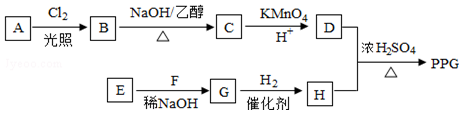
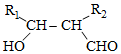
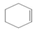 在酸性高锰酸钾溶液中反应生成HOOCCH2CH2CH2CH2COOH
在酸性高锰酸钾溶液中反应生成HOOCCH2CH2CH2CH2COOH .
. .
.
 :
: