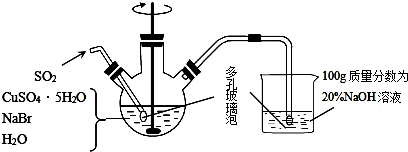
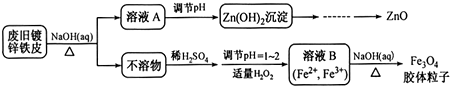
题目内容
1.反应2H2O2(l)?2H2O(l)+O2(g)能量变化如图所示,下列说法错误的是( )
| A. | 途径Ⅱ与途径Ⅰ相比,可能是加入了二氧化锰 | |
| B. | 2 molH2O2(l)的能量高于2 molH2O(l)的能量 | |
| C. | 其他条件相同,产生相同量O2时途径Ⅰ放出热量多 | |
| D. | 其他条件相同,产生相同量O2途径Ⅰ耗时多 |
分析 A.途径II的活化能小于途径I;
B.由图可知:反应物的总能量高于生成物的总能量;
C.催化剂只降低活化能,不改变反应的热效应;
D.途径II化学反应速率快.
解答 解:A.由图可知,途径II的活化能减小,可能加入了催化剂二氧化锰,故A正确;
B.此反应为放热反应,即2mol双氧水的总能量高于2molH2O和1molO2的能量之和,则2 molH2O2(l)的能量高于2 molH2O(l)的能量,故B正确;
C.催化剂只降低活化能,不改变反应的热效应,所以其他条件相同,产生相同量O2时途径Ⅰ和途径II放出热量相同,故C错误;
D.途径II加入催化剂,化学反应速率加快,到达平衡的时间缩短,所以其他条件相同,产生相同量O2途径Ⅰ耗时多,故D正确,
故选C.
点评 本题主要考查了化学反应与能量变化,涉及活化能、催化剂影响、反应速率等知识点,难度不大,侧重于考查学生对基础知识的应用能力.

练习册系列答案
相关题目
6.键能是指破坏(或形成)1mol化学键所吸收(或放出)的能量.化学反应就是旧键的断裂和新键的形成的过程.现查得:H-H、Cl-Cl和H-Cl的键能分别为436kJ/mol、243kJ/mol和431kJ/mol,请用此数据估计,由Cl2、H2生成1mol HCl时的热效应( )
| A. | 吸热183 kJ | B. | 放热183 kJ | C. | 放热91.5 kJ | D. | 吸热91.5 kJ |
13.下列有关热化学方程式的书写及对应的表述均正确的是( )
| A. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| B. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热△H=-110.5 kJ•mol-1 |
10.下列说法正确的是( )
| A. | 组成元素相同,组成元素的质量分数也对应相等的不同化合物,一定互为同分异构体 | |
| B. | 组成元素相同,相对分子质量相同的几种化合物,互为同分异构体 | |
| C. | 摩尔质量相同,各元素质量分数也对应相等的不同化合物,一定是同分异构体 | |
| D. | 凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物 |