题目内容
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氮气和水蒸气,并放出大量热.已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出 a kJ的热量.
(1)写出肼和过氧化氢的电子式:肼: ,过氧化氢: ;
(2)写出该反应的热化学方程式: ;
(3)已知H2O(1)═H2O(g)△H=+b kJ/mol,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是 kJ.
(1)写出肼和过氧化氢的电子式:肼:
(2)写出该反应的热化学方程式:
(3)已知H2O(1)═H2O(g)△H=+b kJ/mol,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是
考点:热化学方程式,有关反应热的计算
专题:化学反应中的能量变化
分析:(1)肼分子式为NH2-NH2,每个氮原子形成三个化学键,过氧化氢分子式H2O2,每个氧原子形成两个共价键,据此写出物质的电子式;
(2)依据热化学方程式书写方法写出,标注物质聚集状态和反应焓变;
(3)依据热化学方程式和盖斯定律计算得到热化学方程式,得到反应的焓变.
(2)依据热化学方程式书写方法写出,标注物质聚集状态和反应焓变;
(3)依据热化学方程式和盖斯定律计算得到热化学方程式,得到反应的焓变.
解答:
解:(1)肼是氮原子和氮原子形成一个共价键,剩余价键和氢原子形成共价键,电子式为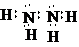 ,双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为:
,双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,故答案为:
,故答案为: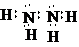 ;
; ;
;
(2)0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出akJ的热量,1mol肼燃烧放热为2.5akJ;肼燃烧的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-2.5akJ/mol,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-2.5akJ/mol;
(3)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-2.5akJ/mol,
②H2O(l)═H2O(g)△H=+bkJ/mol;依据盖斯定律,①-②×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-(2.5a+4b)kJ/mol,
则16g液态肼与足量液态过氧化氢反应生成氮气和液态水放热为(1.25a+2b)kJ,
故答案为:1.25a+2b.
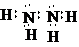 ,双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为:
,双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,故答案为:
,故答案为: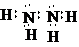 ;
; ;
;(2)0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出akJ的热量,1mol肼燃烧放热为2.5akJ;肼燃烧的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-2.5akJ/mol,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-2.5akJ/mol;
(3)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-2.5akJ/mol,
②H2O(l)═H2O(g)△H=+bkJ/mol;依据盖斯定律,①-②×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-(2.5a+4b)kJ/mol,
则16g液态肼与足量液态过氧化氢反应生成氮气和液态水放热为(1.25a+2b)kJ,
故答案为:1.25a+2b.
点评:本题考查了化学反应能量变化的计算应用,物质结构分析判断,盖斯定律的计算,热化学方程式书写方法,题目难度中等.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
实验得出,无水氯化铝在常压条件下不同温度时的密度为
可见,400℃时无水氯化铝存在形式的化学式为( )
| t(℃) | 200 | 400 | 600 | 800 |
| ρ(g/L) | 6.881 | 4.236 | 2.650 | 1.517 |
| 气体摩尔体积(L/mol) | 38.8 | 55.2 | 71.6 | 88.0 |
| A、AlCl3 |
| B、Al2Cl6 |
| C、AlCl3和Al2Cl6 |
| D、Al3Cl9和Al2Cl6 |
在溶液中能大量共存的一组离子或分子是( )
| A、NH4+、H+、NO3-、HCO3- |
| B、K+、Al(OH)4-、SO42-、NH3?H2O |
| C、Na+、K+、SO32-、ClO- |
| D、Na+、CH3COO-、SO42-、H+ |
下列说法正确的是( )
| A、CH3-CH=CH2分子中所有原子一定处于同一平面 |
| B、除去乙烷中的乙烯是将混气通入酸性KMnO4溶液中 |
| C、若烃中碳、氢元素的质量分数相同,它们可能是同系物 |
| D、某烷烃的命名为3,4,4一三甲基己烷 |

 重晶石(主要成分BaSO4)是制取可溶性钡盐的重要原料,工业上可用重晶石、焦炭、空气煅烧可制取BaS,其主要反应的热化学方程式如下:
重晶石(主要成分BaSO4)是制取可溶性钡盐的重要原料,工业上可用重晶石、焦炭、空气煅烧可制取BaS,其主要反应的热化学方程式如下: