题目内容
13.下列除杂质选用试剂和主要操作都正确的是( )| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| B | NaHCO3 | NH4Cl | - | 加热 |
| C | Fe | Al | 氢氧化钠 | 洗气 |
| D | 乙烷 | 乙烯 | 溴水 | 蒸馏 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
分析 A.氧化铁与盐酸反应,而二氧化硅不反应;
B.二者加热均分解;
C.Al与NaOH溶液反应,而Fe不能;
D.乙烯与溴水反应,而乙烷不能.
解答 解:A.氧化铁与盐酸反应,而二氧化硅不反应,则与足量盐酸反应后、过滤可除杂,故A正确;
B.二者加热均分解,则加热不能分离,故B错误;
C.Al与NaOH溶液反应,而Fe不能,则与足量NaOH反应后、过滤可除杂,故C错误;
D.乙烯与溴水反应,而乙烷不能,洗气可除杂,故D错误;
故选A.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列变化过程中,只破坏离子键的是( )
| A. | 水变成冰 | B. | 电解熔融NaCl | C. | HCl溶于水 | D. | NH4Cl受热分解 |
4.下列关于糖类、蛋白质、油脂的说法正确的是( )
| A. | 糖类在一定条件下都可以水解生成乙醇和二氧化碳 | |
| B. | 乙酸乙酯和油脂都属于酯类物质,碱性条件水解称之为皂化反应 | |
| C. | 硝酸汞溶液加入到鸡蛋清中,可以使蛋清液盐析而沉淀下来 | |
| D. | 淀粉在稀硫酸加热催化下,水解产物葡萄糖的检出,先加入NaOH溶液后加入银氨溶液水浴加热,看是否有银镜出现.若出现银镜,证明有葡糖糖生成 |
1. 乙醛(CH3CHO)在催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次,反应基本完全.有关物质的沸点见表:
乙醛(CH3CHO)在催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次,反应基本完全.有关物质的沸点见表:
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$\frac{\underline{\;\;\;\;\;\;\;CuO\;\;\;\;\;\;\;}}{60℃-80℃}$2CH3COOH.
(2)如图所示,在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在浸入试管A的反应液中;当试管A内的主要反应完成后温度计水银球的位置应在试管A的支管口处.
(3)烧杯B内盛装的液体可以是甘油.
(4)试管C中收集到的是粗产品,若想进一步提纯,可采用的方法是蒸馏;提纯后的产品若在质谱仪中进行测定,其质荷比最大是60(填数值);若在核磁共振仪中进行测定,其核磁共振氢谱共有2种峰,峰面积之比为3:1或1:3.
 乙醛(CH3CHO)在催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次,反应基本完全.有关物质的沸点见表:
乙醛(CH3CHO)在催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次,反应基本完全.有关物质的沸点见表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙醇 | 水 |
| 沸点/℃ | 20.8 | 117.9 | 290 | 78.2 | 100 |
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$\frac{\underline{\;\;\;\;\;\;\;CuO\;\;\;\;\;\;\;}}{60℃-80℃}$2CH3COOH.
(2)如图所示,在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在浸入试管A的反应液中;当试管A内的主要反应完成后温度计水银球的位置应在试管A的支管口处.
(3)烧杯B内盛装的液体可以是甘油.
(4)试管C中收集到的是粗产品,若想进一步提纯,可采用的方法是蒸馏;提纯后的产品若在质谱仪中进行测定,其质荷比最大是60(填数值);若在核磁共振仪中进行测定,其核磁共振氢谱共有2种峰,峰面积之比为3:1或1:3.
8.某溶液中存在大量的NH4+、Ba2+、Cl-,该溶液中还可能大量存在的是( )
| A. | SO42一 | B. | K+ | C. | Ag+ | D. | OH- |
18.下列物质中,在一定条件下不能发生水解反应的是( )
| A. | 葡萄糖 | B. | 淀粉 | C. | 蛋白质 | D. | 纤维素 |
2.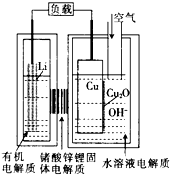 正在研制的一种“高容量、低成本”锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
正在研制的一种“高容量、低成本”锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
 正在研制的一种“高容量、低成本”锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
正在研制的一种“高容量、低成本”锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 通空气时,铜被腐蚀,表面产生CuO | |
| B. | 放电一段时间后右侧水溶液电解质中LiOH浓度逐渐增大 | |
| C. | 放电时,正极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH- | |
| D. | 整个反应过程中,铜相当于催化剂 |
3.NCl3的电子式为 ,则NCl3与H2O反应时.最初的生成物一定有( )
,则NCl3与H2O反应时.最初的生成物一定有( )
 ,则NCl3与H2O反应时.最初的生成物一定有( )
,则NCl3与H2O反应时.最初的生成物一定有( )| A. | NH3 | B. | HNO2 | C. | HClO | D. | NH4Cl |