题目内容
 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=a kJ?mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g)△H2=b kJ?mol-1
2CO(g)+O2(g)=2CO2(g)△H3=c kJ?mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g) 的△H=
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
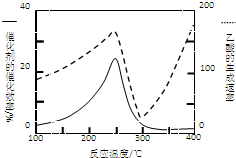
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是
②为了提高该反应中CH4的转化率,可以采取的措施是
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为
(3)以CO2为原料可以合成多种物质.
①利用FeO吸收CO2的化学方程式为:6 FeO+CO2=2Fe3O4+C,则反应中每生成1 mol Fe3O4,转移电子的物质的量为
②以氢氧化钾水溶液作电解质进行电解,在铜电极上CO2可转化为CH4,另一电极石墨连接电源的
考点:电解原理,用盖斯定律进行有关反应热的计算,化学反应速率的影响因素
专题:
分析:(1)根据盖斯定律结合已知热化学方程式来解答;
(2)①根据温度对催化剂活性的影响;
②根据外界条件对化学平衡的影响,平衡正向移动,反应物转化率增大;
③先将Cu2Al2O4拆成氧化物的形式:Cu2O?Al2O3,再根据氧化物与酸反应生成离子方程式,需要注意的是一价铜具有还原性;
(3)①根据化合价升降以及电子转移计算反应生成1molFe3O4电子转移的量;
②根据原电池原理,CO2在正极发生还原反应转化为甲烷,注意电解质溶液为碱性.
(2)①根据温度对催化剂活性的影响;
②根据外界条件对化学平衡的影响,平衡正向移动,反应物转化率增大;
③先将Cu2Al2O4拆成氧化物的形式:Cu2O?Al2O3,再根据氧化物与酸反应生成离子方程式,需要注意的是一价铜具有还原性;
(3)①根据化合价升降以及电子转移计算反应生成1molFe3O4电子转移的量;
②根据原电池原理,CO2在正极发生还原反应转化为甲烷,注意电解质溶液为碱性.
解答:
解:(1)CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=akJ?mol-1 ①
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=bkJ?mol-1 ②
2CO(g)+O2(g)=2CO2(g)△H=ckJ?mol-1 ③
根据盖斯定律,由①+②×2-③×2得,CO2(g)+CH4(g)?2CO(g)+2H2(g)△H=(a+2b?2c)kJ?mol-1.
故答案为:a+2b?2c;
(2)①温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,故答案:温度超过250℃时,催化剂的催化效率降低;
②增大反应压强、增大CO2的浓度,平衡正向移动,反应物转化率增大,故答案为:增大反应压强、增大CO2的浓度;
③Cu2Al2O4拆成氧化物的形式:Cu2O?Al2O3,与酸反应生成离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O,
故答案为:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O;
(3)①该反应中每生成1molFe3O4,反应的二氧化碳物质的量为0.5mol,1mol二氧化碳反应转移电子4mol,0.5mol二氧化碳反应转移电子2mol,所以转移电子的物质的量2mol;
故答案为:2;
②CO2在正极发生还原反应转化为甲烷,电极反应为:CO2+8e-+6H2O=CH4+8OH-,阳极上是氢氧根离子失电子的氧化反应,产生氧气,总的电解原理方程式为:CO2+2H2O
CH4+2O2,故答案为:正;CO2+2H2O
CH4+2O2.
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=bkJ?mol-1 ②
2CO(g)+O2(g)=2CO2(g)△H=ckJ?mol-1 ③
根据盖斯定律,由①+②×2-③×2得,CO2(g)+CH4(g)?2CO(g)+2H2(g)△H=(a+2b?2c)kJ?mol-1.
故答案为:a+2b?2c;
(2)①温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,故答案:温度超过250℃时,催化剂的催化效率降低;
②增大反应压强、增大CO2的浓度,平衡正向移动,反应物转化率增大,故答案为:增大反应压强、增大CO2的浓度;
③Cu2Al2O4拆成氧化物的形式:Cu2O?Al2O3,与酸反应生成离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O,
故答案为:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O;
(3)①该反应中每生成1molFe3O4,反应的二氧化碳物质的量为0.5mol,1mol二氧化碳反应转移电子4mol,0.5mol二氧化碳反应转移电子2mol,所以转移电子的物质的量2mol;
故答案为:2;
②CO2在正极发生还原反应转化为甲烷,电极反应为:CO2+8e-+6H2O=CH4+8OH-,阳极上是氢氧根离子失电子的氧化反应,产生氧气,总的电解原理方程式为:CO2+2H2O
| ||
| ||
点评:本题主要考查盖斯定律、影响化学反应速率和平衡的因素以及原电池原理的运用等知识,难度不大,根据所学知识即可完成.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
VmL密度为ρ g?mL-1的某溶液,含有相对分子质量为 M 的溶质m g,该溶液中溶质的质量分数为ω,物质的量浓度为c mol?L-1,则下列关系式正确的是( )
A、m=
| ||
B、c=
| ||
C、ω=
| ||
D、c=
|
某元素X所形成的分子X2共有3种,其相对分子质量依次为158、160、162,其三种分子的物质的量之比是7:10:7则下列结论正确的是( )
| A、X有三种同位素 |
| B、其中一种同位素的原子质量数为81 |
| C、质量数为79的同位素,其原子质量分数为50% |
| D、X2的平均相对分子质量为159 |
酱油中氯丙醇的超标问题一直备受世人关注,在氯丙醇家族中有一种三氯丙醇(分子中只含一个羟基),三氯丙醇有多种同分异构体,其中羟基和氯原子不在同一个碳原子上的异构体有(不考虑立体异构)( )
| A、4种 | B、5种 | C、6种 | D、7种 |
向下列溶液:①氯水 ②氯酸钾 ③氯化钠 ④四氯化碳中分别加AgNO3溶液和稀HNO3,能生成白色沉淀的是( )
| A、①② | B、②③ | C、①③ | D、②④ |
用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示.下列说法正确的是( )

| A、充电时,阴极的电极反应为:Ni(OH2)+OH--e-=NiO(OH)+H2O |
| B、放电时,负极的电极反应为:H2-2e-+2OH-═2H2O |
| C、放电时,OH-移向镍电极 |
| D、充电时,将电池的碳电极与外电源的正极相连 |
下列两种气体的分子数一定相等的是( )
| A、质量相等而密度不等的N2和CO |
| B、等体积、等密度的CO和NO |
| C、等温、等体积的N2 和O2 |
| D、等压、等体积的N2和CO2 |
下列物质中属于油脂的是( )
A、 |
B、 |
C、 |
D、 |
 碱式碳酸钴[Cox(OH)y(C03)z]常用作电子材料、磁性材料的添加剂,受热时可分解生喊三种氧化物.为了确定其组成,某化学兴趣小组同学设计了如图1所示的装置进行实验.
碱式碳酸钴[Cox(OH)y(C03)z]常用作电子材料、磁性材料的添加剂,受热时可分解生喊三种氧化物.为了确定其组成,某化学兴趣小组同学设计了如图1所示的装置进行实验.