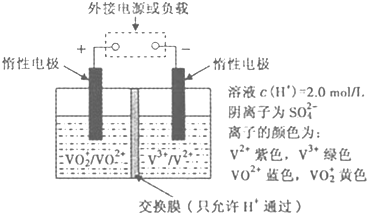
题目内容
3. 有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品.其构想分成3个步骤:
有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品.其构想分成3个步骤:①利用浓碳酸钾溶液吸收空气中的CO2;
②将第①步吸收液电解产生H2和O2,同时分离出CO2;
③将第②步产生的H2和CO2在一定条件下转化成CH4和水蒸气.
已知:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H1=-285.8kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2=-889.6kJ/mol
H2O(l)=H2O(g)△H3=+44.0kJ/mol
(1)第③步反应的热化学方程式为CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-165.6kJ/mol.
(2)若在第②步电解吸收液时产生11.2LO2(标准状况下),则第③步中最多可制得5.6L甲烷(标准状况下)
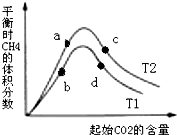
(3)为探究在密闭容器中进行第③步反应的最佳投料比,某研究小组向恒温(T1、T2均大于100℃)恒容容器中充入一定量的H2,在其他条件不变的情况下,改变起始CO2的物质的量测定达到平衡时CH4的体积分数,实验结果如图所示.则a、c两点处所的平衡状态中,氢气的转化率的大小关系是α(a)<α(c)(填“>”“<”或“=”),a、b、c、d四点所处的平衡状态中,对应的平衡常数Ka、Kb、Kc、Kd的大小关系是Ka=Kc>Kb=Kd.
分析 (1)已知:①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H1=-285.8kJ/mol
②CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2=-889.6kJ/mol
③H2O(l)=H2O(g)△H3=+44.0kJ/mol
根据盖斯定律,①×4-②+③×2可得:CO2(g)+4H2(g)=CH4(g)+2H2O(g);
(2)根据方程式:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑、CO2+4H2=CH4+2H2O,可得关系式2H2 ~O2 ~$\frac{1}{2}$CH4;
(3)增大二氧化碳的浓度平衡正移,氢气的转化率增大;
平衡常数只与温度有关,正反应为吸热反应,升高温度平衡逆移,K要减小.
解答 解:(1)已知:①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H1=-285.8kJ/mol
②CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2=-889.6kJ/mol
③H2O(l)=H2O(g)△H3=+44.0kJ/mol
根据盖斯定律,①×4-②+③×2可得:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-165.6kJ/mol,
故答案为:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-165.6kJ/mol;
(2)根据方程式:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑、CO2+4H2=CH4+2H2O,可得关系式2H2 ~O2 ~$\frac{1}{2}$CH4,故收集11.2L氧气时,可以制得甲烷为11.2L×$\frac{1}{2}$=5.6L,
故答案为:5.6L;
(3)增大二氧化碳的浓度平衡正移,氢气的转化率增大,所以氢气的转化率的大小关系是:a(a)<a(c);
正反应为放热反应,升高温度平衡逆向移动,甲烷的含量减小,故温度T1>T2,而平衡常数只与温度有关,升高温度平衡逆移,K要减小,故平衡常数Ka=Kc>Kb=Kd,
故答案为:<;Ka=Kc>Kb=Kd;
点评 本题考查化学平衡影响因素、化学平衡图象、平衡常数、盖斯定律应用等,(2)中注意利用关系式解答,注意平衡常数只受温度影响.

| A. | 1mol固态焦炭与1mol水蒸气反应产生1mol一氧化碳和1mol氢气,吸收131.3 kJ的热量 | |
| B. | 碳与水反应吸收131.3 kJ的热量 | |
| C. | 1mol碳和1mol水反应吸收131.3 kJ的热量 | |
| D. | 固态碳和气态水各1mol反应,放出131.3 kJ的热量 |
| A. | 1L溶液里含有NA个SO42- | |
| B. | 1L溶液里K+离子数比SO42-离子数少NA个 | |
| C. | 2L溶液里,阴、阳离子的总数大于4NA个 | |
| D. | 2L溶液里,Al3+离子个数一定小于NA个 |
| A. | 溴乙烷 | B. | 乙醚 | C. | 乙醇 | D. | 乙烯 |