题目内容
8.下列有关“化学与生活”的叙述不正确的是( )| A. | “地沟油”禁止食用,但可以用来制肥皂 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 | |
| D. | 葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 |
分析 A、油脂碱性条件下水解,可生成肥皂;
B、明矾溶液即KAl(SO4)3溶液,水解显酸性;
C、人体内没有能消化纤维素的酶;
D、苏打溶液显碱性.
解答 解:A、地沟油的主要成分是油脂,油脂碱性条件下水解成为造化反应,可生成肥皂,故A正确;
B、明矾溶液即KAl(SO4)3溶液,水解显酸性,铜锈为Cu2(OH)2CO3,故明矾溶液能清除铜镜上的铜锈,故B正确;
C、人体内没有能消化纤维素的酶,故纤维素不能在人体内被消化,故C错误;
D、苏打溶液即碳酸钠溶液,水解显碱性,故能使真红酒显蓝色,故能鉴别红酒的真假,故D正确.
故选C.
点评 本题考查了化学在日常生活中的应用,难度不大,特别应注意盐类的水解在生活中的应用.

练习册系列答案
相关题目
15.已知:H2(g)+Br2(l)═2HBr(g)△H=-72kJ/mol,蒸发1molBr2(l)变为1molBr2(g)需吸收30kJ能量.又知:1mol相关分子中的化学键断裂需吸收的能量如下:
则表中a为( )
| H2(g) | Br2(g) | HBr(g) |
| 436kJ | akJ | 369kJ |
| A. | 200 | B. | 230 | C. | 260 | D. | 404 |
16.如图是部分短周期元素原子半径与原子序数的关系图.字母代表元素,分析正确的是( )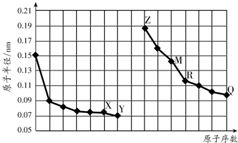

| A. | R在周期表的第15列 | |
| B. | 简单离子的半径:X>Z>M | |
| C. | Y、Q两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 | |
| D. | Z的单质能从M与Q元素构成的盐溶液中置换出单质M |
3.关于下列装置说法正确的是( )
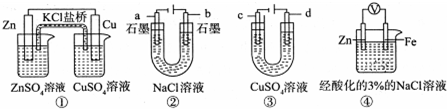

| A. | 装置①中,盐桥中的 K+移向CuSO4溶液 | |
| B. | 装置②在电解过程中,a极上得到22.4 L气体(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数) | |
| C. | 可以用装置③在铜上镀银,c极为银 | |
| D. | 装置④中一段时间后会有Fe(OH)2生成 |
20.25℃时,下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | pH=7的NaHSO3与Na2SO3混合溶液中:3c(Na+)=c(HSO3-)+c(SO32-) | |
| B. | 0.1mol•L-1的KHA溶液,其PH=10:c(K+)>c(OH-)>c(HA-)>c(H+) | |
| C. | 20mL0.1mol•L-1醋酸钠溶液与10mL 0.1mol•L-1盐酸混合后的溶液中: 2 c(H+)+c(CH3COOH)=c(CH3COO-)+2 c(OH-) | |
| D. | 在25mL 0.1 mol•L-1NaOH溶液中逐滴加入0.2mol•L-1CH3COOH溶液,溶液pH变化如图所示,在A、B间任一点,溶液中一定都存在下列关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)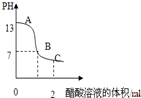 |
17.科学研究与工业生产中常常用到溶液中的反应.
(1)25℃时,0.05mol•L-1Ba(OH)2溶液的pH=13,将该Ba(OH)2溶液与pH=2的HCl溶液混合,若所得混合溶液pH=7,则Ba(OH)2溶液与HCl溶液的体积比为1:10.
(2)CO2可转化成有机物实现碳循环:CO2$\stackrel{H_{2}}{→}$CH3OH$\stackrel{O_{2}}{→}$HCOOH…
25℃时,几种酸的电离平衡常数如下:
回答下列问题:
①用离子方程式表示HCOONa溶液呈碱性的原因HCOO-+H2O?HCOOH+OH-.
②物质的量浓度均为0.1mol•L-1的下列四种物质:
a.Na2CO3b.NaClO c.HCOONa d.NaHCO3,pH由大到小的顺序是a>b>d>c(填编号).
(3)常温下,将0.2mol•L-1的HCOOH和0.1mol•L-1的NaOH溶液等体积混合,所得溶液的pH<7,说明所得混合溶液中HCOOH的电离程度大于HCOONa的水解程度(填“大于”“等于”或“小于”).
(4)含有Cr2O的废水毒性较大,某工厂废水中含5.00×10-3 mol•L-1的Cr2O72-.为使废水能达标排放,做如下处理:Cr2O${\;}_{7}^{2-}$$→_{H+}^{绿矾}$Cr3+、Fe3+$\stackrel{石灰水}{→}$Cr(OH)3、Fe(OH)3.若处理后的废水中残留的c(Fe3+)=2×10-13 mol•L-1,则残留的Cr3+的浓度为3×10-6mol•L-1 (已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31).
(1)25℃时,0.05mol•L-1Ba(OH)2溶液的pH=13,将该Ba(OH)2溶液与pH=2的HCl溶液混合,若所得混合溶液pH=7,则Ba(OH)2溶液与HCl溶液的体积比为1:10.
(2)CO2可转化成有机物实现碳循环:CO2$\stackrel{H_{2}}{→}$CH3OH$\stackrel{O_{2}}{→}$HCOOH…
25℃时,几种酸的电离平衡常数如下:
| 化学式 | HCOOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-4 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①用离子方程式表示HCOONa溶液呈碱性的原因HCOO-+H2O?HCOOH+OH-.
②物质的量浓度均为0.1mol•L-1的下列四种物质:
a.Na2CO3b.NaClO c.HCOONa d.NaHCO3,pH由大到小的顺序是a>b>d>c(填编号).
(3)常温下,将0.2mol•L-1的HCOOH和0.1mol•L-1的NaOH溶液等体积混合,所得溶液的pH<7,说明所得混合溶液中HCOOH的电离程度大于HCOONa的水解程度(填“大于”“等于”或“小于”).
(4)含有Cr2O的废水毒性较大,某工厂废水中含5.00×10-3 mol•L-1的Cr2O72-.为使废水能达标排放,做如下处理:Cr2O${\;}_{7}^{2-}$$→_{H+}^{绿矾}$Cr3+、Fe3+$\stackrel{石灰水}{→}$Cr(OH)3、Fe(OH)3.若处理后的废水中残留的c(Fe3+)=2×10-13 mol•L-1,则残留的Cr3+的浓度为3×10-6mol•L-1 (已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31).
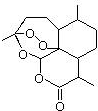
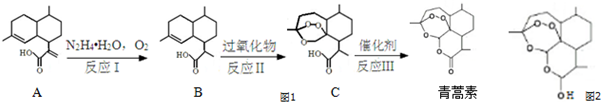
 ,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)
,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)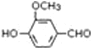 )可用于合成青蒿素,合成天然香草醛的反应如图:
)可用于合成青蒿素,合成天然香草醛的反应如图: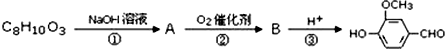
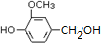 .
.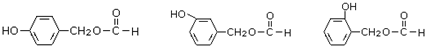 .
.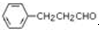 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).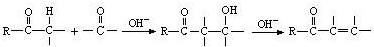
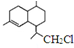 为原料合成B,写出其合成路线(指明所用试剂和反应条件).
为原料合成B,写出其合成路线(指明所用试剂和反应条件).