题目内容
18.下列不能形成配位键的是( )| A. | Ag+ NH3 | B. | Cu2+ NH3 | C. | H+ H2O | D. | Ag+ CH4 |
分析 含有孤电子对和含有空轨道的原子之间能形成配位键,配位键属于共价键,根据配位键形成的条件分析,一方要提供空轨道,另一方提供孤电子对,据此进行答题.
解答 解:A.Ag+有空轨道,NH3中的氮原子上的孤电子对,可以形成配位键,故A不选;
B.Cu2+有空轨道,NH3中的氮原子上的孤电子对,可以形成配位键,故B不选;
C.水分子中的O原子含有孤电子对,H+有空轨道,所以能形成配位键,故C不选;
D.Ag+有空轨道,Ag+、CH4两种微粒都没有孤电子对,所以不能形成配位键,故D选;
故选D.
点评 本题考查了配位键的成键情况,题目难度不大,明确配位键的形成条件是解本题关键,熟悉常见微粒中是否含有孤电子对或空轨道,只要符合配位键的形成条件就能形成配位键.

练习册系列答案
相关题目
8.如表是A、B、C、D四种有机物的有关信息:
回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的结构简式是CH2BrCH2Br.
A与水在一定条件下反应生成C的化学方程式是CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH
(2)A与氢气发生加成反应后生成物质E,E的组成符合通式CnH2n+2.
当n=C时,这类有机物开始出现同分异构体.
A.2 B.3 C.4 D.5
(3)B具有的性质是B.
A.无色无味液体,密度比水大 B.有毒,不溶于水
C.与酸性KMnO4溶液和溴水反应褪色 D.任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$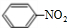 +H2O.
+H2O.
(4)C与D反应生成的产物名称是乙酸乙酯,该反应的反应类型为取代反应或酯化反应.
| A | ①能使溴的四氯化碳溶液褪色; ②填充模型为  ; ;③能与水在一定条件下反应生成C. |
| B | ①由C、H两种元素组成; ②球棍模型为  . . |
| C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与D反应生成一种有香味的油状物. |
| D | ①由C、H、O三种元素组成; ②球棍模型为  . . |
(1)A与溴的四氯化碳溶液反应的生成物的结构简式是CH2BrCH2Br.
A与水在一定条件下反应生成C的化学方程式是CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH
(2)A与氢气发生加成反应后生成物质E,E的组成符合通式CnH2n+2.
当n=C时,这类有机物开始出现同分异构体.
A.2 B.3 C.4 D.5
(3)B具有的性质是B.
A.无色无味液体,密度比水大 B.有毒,不溶于水
C.与酸性KMnO4溶液和溴水反应褪色 D.任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$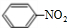 +H2O.
+H2O.(4)C与D反应生成的产物名称是乙酸乙酯,该反应的反应类型为取代反应或酯化反应.
13.下列各组物质各自形成晶体,均属于分子晶体的化合物是( )
| A. | NH3、H2、C2H6 | B. | H2O、CO2、H2SO4 | C. | SO2、SiO2、P2O5 | D. | CCl4、SiC、H2O2 |
10.下列说法正确的是( )
| A. | 将煤干馏可以提高能源的利用率 | |
| B. | 甲烷也是一种温室气体,应禁止使用天然气 | |
| C. | 锌-锰干电池是对环境没任何污染的理想电池 | |
| D. | 寻找高效催化剂,使二氧化硅分解产生硅的同时释放能量 |
7.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )


| A. | 铜电极上发生反应Cu-2e-=Cu2+ | |
| B. | 工作一段时间后,乙池的c(SO42-)减小 | |
| C. | 电流从铜极经过导线移向锌极 | |
| D. | 电池工作一段时间后,甲池的c(Zn2+)增加 |
8.离子方程式:Al3++3AlO2-+6H2O═4Al(OH)3↓,不能表示下列实验中某一过程的是( )
| A. | 向铝盐溶液中不断加入偏铝酸钠溶液 | |
| B. | 向盐酸中不断加入偏铝酸钠溶液 | |
| C. | 向氢氧化钠溶液中加铝盐溶液 | |
| D. | 向偏铝酸盐中下断加入盐酸 |
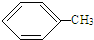 +3HO-NO2$\stackrel{浓硫酸}{→}$
+3HO-NO2$\stackrel{浓硫酸}{→}$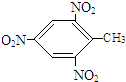 +3H2O.
+3H2O. .
.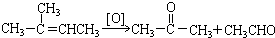
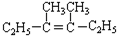 在上述类似条件下发生反应,请写出反应的方程式
在上述类似条件下发生反应,请写出反应的方程式 .
. 用如图所示的装置进行电解,在通电一段时间后,铁电极的质量增加.
用如图所示的装置进行电解,在通电一段时间后,铁电极的质量增加.