题目内容
浓度均为0.1mol/L的NaOH溶液与氨水相比较,下列结论正确的是( )
| A、中和HCl的物质的量相同 |
| B、两溶液中所含的OH-数目相同 |
| C、NaOH溶液中c(H+)小 |
| D、氨水中c(OH-)大 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:根据NaOH溶液与氨水的浓度均为0.1mol/L,氢氧化钠是强电解完全电离,一水合氨是弱电解质部分电离,因此氢氧化钠溶液中的氢氧根离子的浓度比氨水中的大,根据水的离子积常数,则NaOH溶液中H+浓度小;由于两溶液的体积不确定,因此两溶液中溶质的物质的量不确定,中和酸的量不确定,溶液中离子的物质的量也不确定,离子的数目不确定.
解答:
解:A.两溶液的浓度虽然相等,但体积不确定,因此溶液中溶质的物质的量是不确定的,物质的反应是以物质的量为标准进行计算的,因此中和HCl的量是不确定的,故A错误;
B.因为题意中只是知道两溶液的浓度,不知道溶液的体积,故无法确定溶液中溶质的物质的量,则两溶液中所含的OH-的物质的量不确定,离子的数目也不确定,故B错误;
C.NaOH溶液与氨水的浓度均为0.1mol/L,氢氧化钠是强电解完全电离,一水合氨是弱电解质部分电离,因此氢氧化钠溶液中的氢氧根离子的浓度比氨水中的大,根据水的离子积常数,一定温度下,Kw═c(H+)?c(OH-),c(OH-)越大,c(H+)越小,故NaOH溶液中H+浓度小,故C正确;
D.根据对C的分析,氢氧化钠溶液中c(OH-)大,氨水溶液中c(OH-)小,故D错误.
故选C.
B.因为题意中只是知道两溶液的浓度,不知道溶液的体积,故无法确定溶液中溶质的物质的量,则两溶液中所含的OH-的物质的量不确定,离子的数目也不确定,故B错误;
C.NaOH溶液与氨水的浓度均为0.1mol/L,氢氧化钠是强电解完全电离,一水合氨是弱电解质部分电离,因此氢氧化钠溶液中的氢氧根离子的浓度比氨水中的大,根据水的离子积常数,一定温度下,Kw═c(H+)?c(OH-),c(OH-)越大,c(H+)越小,故NaOH溶液中H+浓度小,故C正确;
D.根据对C的分析,氢氧化钠溶液中c(OH-)大,氨水溶液中c(OH-)小,故D错误.
故选C.
点评:本题考查强弱电解质的电离情况,进一步分析溶液微粒量的关系,要细心认真,知识分析到位,否则将出现错误.

练习册系列答案
相关题目
下列实验操作及其先后顺序均正确的是( )
| A、先装好药品,再检查装置的气密性 |
| B、先用双手捂紧试管,再将导管插入水中检查装置的气密性 |
| C、氢气还原氧化铜的实验,先通一段时间的氢气,后检验氢气纯度,再加热 |
| D、稀释浓硫酸时,先在烧杯里倒入浓硫酸,再小心倒入水并不断搅拌 |
IBr的化学性质与卤素单质相似,能与金属反应生成金属卤化物,也可以与水发生如下反应:IBr+H2O=HIO+HBr 下列说法正确的是( )
| A、在IBr中,碘和溴的化合价均为零 |
| B、IBr与水反应时,IBr既是氧化剂又是还原剂 |
| C、IBr与钾反应,化学方程式是2K+IBr=KI+KBr |
| D、IBr与Ca(OH)2溶液反应,产物有CaI2、Ca(BrO)2和H2O |
 如图表示反应X(g)+Y(s)?Z(s)+R(g)(△H<0)的正、逆反应速率(v)与时间(t)的关系,t1时开始改变条件,则改变的条件符合曲线的是( )
如图表示反应X(g)+Y(s)?Z(s)+R(g)(△H<0)的正、逆反应速率(v)与时间(t)的关系,t1时开始改变条件,则改变的条件符合曲线的是( )| A、减少物质Z | B、升温 |
| C、减压 | D、用催化剂 |
下列化合物中价键极性最小是( )
| A、MgCl2 |
| B、AlCl3 |
| C、SiCl4 |
| D、PCl5 |
2014年6月10日是“全国低碳日”,主题是“携手节能低碳,共建碧水蓝天”.下列做法不符合“节能低碳”理念的是( )
| A、提倡双面使用纸张 |
| B、推广一次性竹筷 |
| C、提倡使用太阳能热水器 |
| D、推广公用自行车 |
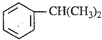 ),是一种重要的有机化工原料.根据题意完成下列填空:
),是一种重要的有机化工原料.根据题意完成下列填空: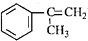 )是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法
)是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法