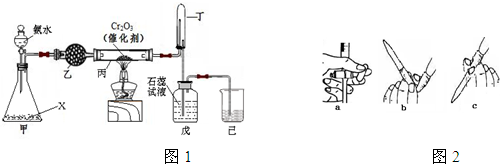
题目内容
1.根据要求回答下列问题:一氧化碳被广泛应用于冶金工业和电子工业.
(1)高炉炼铁是最为普遍的炼铁方法,相关反应的热化学方程式如下:
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s)△H=a kJ•mol-1
CO(g)+3Fe2O3(s)=CO2(g)+2Fe3O4(s)△H=b kJ•mol-1
反应3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)的△H=$\frac{(2a+b)}{3}$kJ•mol-1
(用含a、b 的代数式表示).
(2)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到.
第一步:2CH3OH(g)?HCOOCH3(g)+2H2(g)△H>0
第二步:HCOOCH3(g)?CH3OH(g)+CO(g)△H>0
在工业生产中,为提高CO的产率,可采取的合理措施有升高温度,降低压强.
分析 (1)已知:①4CO(g)+Fe3O4(s)═4CO2(g)+3Fe(s)△H=a kJ•mol-1
②CO(g)+3Fe2O3(s)═CO2(g)+2Fe3O4(s)△H=b kJ•mol-1
依据盖斯定律$\frac{2×①+②}{3}$得到目标方程式;
(2)该反应是气体体积增大的吸热反应,依据化学平衡移动原理分析判断.
解答 解:(1)①4CO(g)+Fe3O4(s)═4CO2(g)+3Fe(s)△H=a kJ•mol-1
②CO(g)+3Fe2O3(s)═CO2(g)+2Fe3O4(s)△H=b kJ•mol-1
依据盖斯定律$\frac{2×①+②}{3}$得到反应热化学方程式为:3CO(g)+Fe2O3(s)═3CO2(g)+2Fe(s)的△H=$\frac{2a+b}{3}$KJ/mol,
故答案为:$\frac{2a+b}{3}$;
(2)第二步:HCOOCH3(g)?CH3OH(g)+CO(g)△H>0,反应是气体体积增大的吸热反应,依据平衡移动原理可知提高一氧化碳产率,应使平衡正向进行,升温,减压实现,
故答案为:升高温度,降低压强.
点评 本题考查了反应热的计算、盖斯定律的应用、影响化学平衡移动的因素,题目难度不大,侧重于基础知识的考查,注意把握盖斯定律的含义和应用方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.一定条件下,可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算分压=总压×物质的量分数.在恒温恒压条件下,总压不变,用平衡分压计算平衡常数更方便.下列说法不正确的是( )
| A. | 对于C2H4(g)+H2O(g)?C2H5OH(g),在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为1mol,则用分压表示的平衡常数Kp=$\frac{3}{P}$ | |
| B. | 恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和C的位置的量分别为4mol、2mol和4mol,若此时A、B和C均增加1mol,平衡正向移动 | |
| C. | 恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)?2NH3(g)达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡正向移动 | |
| D. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关 |
12.工业上利用反应在3Cl2+2NH3═N2+6HCl检查氯气管道是否漏气.下列说法错误的是( )
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应Cl2被氧化 | ||
| C. | 该反应不属于复分解反应 | D. | 生成1mol N2有6mol电子转移 |
9.已知在1×105 Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=+242 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ/mol | ||
| C. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ/mol | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ/mol |
16.下列各组离子能够大量共存的是( )
| A. | pH=1的溶液中:Al3+、Mg2+、Cl-、SO42- | |
| B. | 使pH试纸显蓝色的溶液中:Cu2+、Fe2+、NO3-、SO42- | |
| C. | 滴入甲基橙指示剂呈红色的溶液中:K+、NH4+、CO32-、NO3- | |
| D. | 水电离出的c(H+)=1×10-13mol•L-1的溶液中:K+、NH4+、HCO3-、Cl- |
6.常温下,在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| B. | 常温下pH=12的溶液:Na+、K+、SiO32-、NO3- | |
| C. | c(Fe3+)=0.1mol•L-1的溶液:H+、Al3+、I-、SCN- | |
| D. | 加入铝粉生成H2的溶液:K+、Mg2+、SO42-、HCO3- |
13.下列离子方程式表达正确的是( )
| A. | AgNO3溶液中加入过量的氨水:Ag++NH3•H2O=AgOH↓+NH4+ | |
| B. | 铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O | |
| C. | H2O2溶液中滴加酸性KMnO4溶液:2 MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O | |
| D. | 尼泊金酸(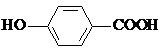 )与碳酸氢钠溶液反应: )与碳酸氢钠溶液反应: |