题目内容
6.已知X、Y元素同周期,且电负性X>Y,下列说法正确的是( )| A. | 第一电离能:Y小于X | |
| B. | 气态氢化物的稳定性:HmY强于HnX | |
| C. | 最高价含氧酸的酸性X弱于Y | |
| D. | X和Y形成化合物时,X显负价Y显正价 |
分析 X、Y元素同周期,且电负性X>Y,则非金属性X>Y.
A.一般非金属性强的,其第一电离能大;
B.非金属性越强,气态氢化物越稳定;
C.非金属性越强,其最高价氧化物的水化物的酸性越强,但O、F除外;
D.电负性大的元素在化合物中显负价.
解答 解:X、Y元素同周期,且电负性X>Y,则非金属性X>Y.
A.一般非金属性强的,其第一电离能大,则第一电离能Y可能小于X,但如为N、O,则第一电离能N>O,故A错误;
B.非金属性越强,气态氢化物越稳定,则气态氢化物的稳定性:HmY小于HnX,故B错误;
C.非金属性越强,其最高价氧化物的水化物的酸性越强,非金属性X>Y,则X对应的酸性强于Y对应的酸的酸性,故C错误;
D.电负性大的元素在化合物中显负价,所以X和Y形成化合物时,X显负价,Y显正价,故D正确;
故选D.
点评 本题考查位置、结构、性质,为高考常见题型,侧重于学生的分析能力的考查,明确同周期位置关系及电负性大小得出元素的非金属性是解答本题的关键,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
16.室温下,将浓度均为0.1mol/L的一元酸HA和NaOH溶液等体积混合,得到混合溶液①,该混合溶液pH=9,下列说法正确的是( )
| A. | 室温下,0.1mol/LHA溶液的pH=1 | B. | 0.1mol/LHA溶液中:c(HA)>c(A-) | ||
| C. | ①溶液中:c(HA)+c(A-)=0.1mol/L | D. | ①溶液中:c(A-)>c(Na+)>c(OH-)>c(H+) |
11.全世界每年铜的产量为 8×106t,工业上由辉铜矿(主要成分是Cu2S,其中铜元素为+1价)生产铜的主要反应为:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2下列说法正确的是( )
| A. | Cu2S的摩尔质量为160 | |
| B. | 每生产1molCu需转移2mol电子 | |
| C. | 该反应中Cu2S既是氧化剂又是还原剂 | |
| D. | 若用该反应生产铜,全世界每年产生的SO2的体积为1.4×106L |
3.美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图.
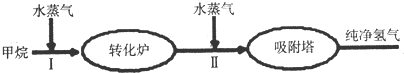
(1)此流程的第Ⅱ步反应为:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的化学平衡常数表达式为K=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$;反应的平衡常数随温度的变化如表:
从表中可以推断:此反应是放(填“吸”、“放”)热反应.在830℃下,若开始时间向恒容密闭容器中充入CO与H2O均为1mol,则达到平衡后CO的转化率为50%.
(2)此流程的第Ⅱ步反应CO(g)+H2O(g)?H2(g)+CO2(g),在830℃,以表格的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有B(填实验编号)
(3)如图表示第Ⅱ步反应的速率(v)随时间(t)变化的关系,下列说法中正确的是A.

A.t2时加入了催化剂 B.t3时降低了温度 C.t3时增大了压强.

(1)此流程的第Ⅱ步反应为:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的化学平衡常数表达式为K=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$;反应的平衡常数随温度的变化如表:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(2)此流程的第Ⅱ步反应CO(g)+H2O(g)?H2(g)+CO2(g),在830℃,以表格的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有B(填实验编号)
| 实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |

A.t2时加入了催化剂 B.t3时降低了温度 C.t3时增大了压强.
20.下列说法正确的是( )
| A. | 物质的量是一个新的物理量,它表示的是物质的质量 | |
| B. | 周一上午升旗仪式时,学生和老师的物质的量共有2mol | |
| C. | 物质的量的单位是摩尔,简称摩,用mol表示 | |
| D. | 水的摩尔质量是18g |