题目内容
18.向一定量4%的氢氧化钠溶液中逐滴加入稀盐酸,有关分析错误的是( )| A. | 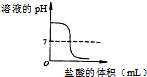 | B. |  | ||
| C. | 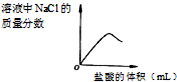 | D. | 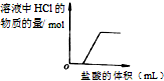 |
分析 A、向氢氧化钠溶液中逐滴加入盐酸,会出现pH的突变;
B、酸碱中和为放热反应,当氢氧化钠和盐酸恰好完全反应时,放出热量达最大值;
C、随着盐酸的逐滴加入,生成的氯化钠的质量逐渐增多,当氢氧化钠和盐酸恰好完全反应时,生成的氯化钠的质量达最大值;
D、当加入的HCl将NaOH完全中和之前,溶液中HCl的物质的量为0,当盐酸过量时,溶液中HCl的物质的量一直增多.
解答 解:A.开始时氢氧化钠溶液是碱性,pH大于7,随着稀盐酸的滴加,pH逐渐减小,但稀盐酸过量时pH小于7,故A正确;
B.酸碱中和反应会放出热量,故随着稀盐酸的加入,溶液的温度升高,当恰好完全中和时,溶液温度最高,继续滴加稀盐酸,溶液的温度就会降低,故B正确;
C.没有滴加稀盐酸时,溶液中氯化钠的质量分数为零,随着加入稀盐酸生成的氯化钠越来越多,溶液中氯化钠的质量分数越来越大,当二者完全中和时,溶液中氯化钠的质量分数达到最大值且不再增加,再滴加稀盐酸,溶液的质量增大,氯化钠的质量不变,溶液中氯化钠的质量分数减小,故C正确;
D.当加入的稀盐酸与氢氧化钠发生反应时,HCl的物质的量为零,当二者恰好完全反应时,继续滴加稀盐酸,HCl的物质的量增加,且随着稀盐酸加入的量的增多,而不断增大,故D错误.
故选D.
点评 本题是化学反应中定量关系和图象相结合的题型,题目难度较大;要准确解答此类题,关键要对化学反应知识熟练,并能结合图象的数学意义,综合考虑,可快速解答;图象的意义要抓住三点:①抓图象的起点,②抓图象的终点,③抓图象的变化过程.

练习册系列答案
相关题目
19.下列物质中属于电解质的是( )
| A. | 硫酸钡 | B. | 氯气 | C. | 铜 | D. | 蔗糖 |
6.下列分子式可以表示3种沸点不同的物质的是( )
| A. | C5H12 | B. | C4H10 | C. | C3H8 | D. | C2H6 |
13.下列化合物中,阴离子和阳离子的半径之比最小的是( )
| A. | CsF | B. | NaF | C. | LiI | D. | KCl |
3.下列关于铝及其化合物的说法中不正确的是( )
| A. | 铝既可以用于食品包装,也可以用于建筑材料 | |
| B. | 氧化铝既可以用来冶炼铝,也可用作耐火材料 | |
| C. | 氢氧化铝既可以用于治疗胃酸过多,也可用来制备一些铝盐 | |
| D. | 明矾既能用来净水,也可用作消毒剂 |
10.X、Y、R、M均为短周期元素,X、Y同周期,X、Y两种元素最高价氧化物对应水化物化学式分别为H2XO4和HYO4.R、M同主族,R与冷水即可反应,M与热水反应缓慢.下列关系正确的是( )
| A. | 原子半径X>Y | B. | 氢化物稳定性H2X>HY | ||
| C. | 原子核内质子数R<M | D. | 溶液碱性R(OH)2<M(OH)2 |
7.下列有关叙述正确的是( )
| A. | 同种元素的原子均具有相同的质子数和中子数 | |
| B. | 不同元素的原子构成的分子只含有极性键 | |
| C. | 第三周期非金属元素气态氢化物的稳定性越强,对应元素的最高价含氧酸的酸性越强 | |
| D. | 第ⅠA族和第ⅦA族元素从上到下随原子序数递增,单质的沸点均逐渐升高 |
 研究碳及其化合物的利用对促进低碳社会的构建具有重要的意义.某学习小组查阅资料并进行相关探究,请帮忙完成以下探究.
研究碳及其化合物的利用对促进低碳社会的构建具有重要的意义.某学习小组查阅资料并进行相关探究,请帮忙完成以下探究.