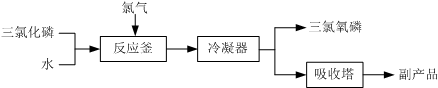
题目内容
6.根据反应式:①Fe+Cu2+═Fe2++Cu ②2Fe3++Cu═2Fe2++Cu2+可判断离子的氧化性从强到弱的顺序是( )
| A. | Fe2+、Fe3+、Cu2+ | B. | Fe2+、Cu2+、Fe3+ | C. | Cu2+、Fe2+、Fe3+ | D. | Fe3+、Cu2+、Fe2+ |
分析 根据元素的化合价的变化判断还原剂和氧化剂,氧化还原反应反应中氧化剂氧化性大于氧化产物的氧化性,以此比较氧化性强弱.
解答 解:由反应①Fe+Cu2+═Fe2++Cu 可知氧化性Fe3+>Cu2+,由反应②2Fe3++Cu═2Fe2++Cu2+可知氧化性Cu2+>Fe2+,则氧化性Fe3+>Cu2+>Fe2+,
故选D.
点评 本题考查氧化还原反应,侧重于概念的理解,为高考高频考点,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,题目难度不大.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目
16.为鉴别K2CO3和NaHCO3两种白色固体,有4位同学分别设计了下列四种不同的方法,其中不可行的是( )
| A. | 分别配成1mol/L的溶液,各取1mL滴加1滴酚酞试液,比较颜色深浅 | |
| B. | 分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 | |
| C. | 分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀 | |
| D. | 分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色(必要时可透过蓝色钴玻璃) |
17.下列有关试剂的保存方法,错误的是( )
| A. | 浓硝酸保存在无色玻璃试剂瓶中 | |
| B. | 氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中 | |
| C. | 少量的钠保存在煤油或石蜡油中 | |
| D. | 新制的氯水通常保存在棕色玻璃试剂瓶中 |
14.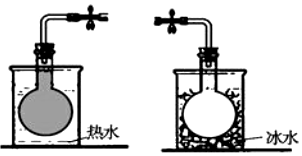 在密封的烧瓶中充入一定量的NO2,发生可逆反应:2NO2?N2O4.不同温度下烧瓶中气体的颜色深浅如图所示.下列有关说法正确的是( )
在密封的烧瓶中充入一定量的NO2,发生可逆反应:2NO2?N2O4.不同温度下烧瓶中气体的颜色深浅如图所示.下列有关说法正确的是( )
 在密封的烧瓶中充入一定量的NO2,发生可逆反应:2NO2?N2O4.不同温度下烧瓶中气体的颜色深浅如图所示.下列有关说法正确的是( )
在密封的烧瓶中充入一定量的NO2,发生可逆反应:2NO2?N2O4.不同温度下烧瓶中气体的颜色深浅如图所示.下列有关说法正确的是( )| A. | 该反应的正反应为吸热反应 | |
| B. | 反应达到平衡时,再充入少量NO2,平衡后NO2的转化率增大 | |
| C. | 反应达到平衡时,再充入少量N2O4,气体颜色变浅 | |
| D. | 反应达到平衡时,增大压强,平衡向正反应方向移动,逆反应速率减小 |
1.下列变化中属于物理变化的是( )
| A. | 湿法炼铜 | B. | 用黏土烧制陶瓷 | C. | 钠灯发光 | D. | 钟乳石的形成 |
18.下列对实验现象的描述与实际事实不一致的是( )
| A. | 向含少量Br2的CCl4中加NaOH溶液,充分振荡,上下两层均为无色 | |
| B. | 向pH试纸上滴加氯水,先变红后变白 | |
| C. | 将红热的铜丝伸入到盛有氯气的集气瓶中,产生蓝绿色的烟 | |
| D. | 往氯水中加入NaHCO3固体,有气体产生 |
15.下列离子方程式正确的是( )
| A. | 将铜丝投入稀硝酸中:Cu+4 H++NO3-=Cu2++NO2↑+2H2O | |
| B. | 浓盐酸与MnO2反应制取氯气:4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O | |
| C. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑ | |
| D. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+H2O |
 A、B、C是单质,其中A是金属,各种物质间的转化关系如图:
A、B、C是单质,其中A是金属,各种物质间的转化关系如图: