题目内容
14.下列说法正确的是( )| A. | 室温下,0.001 mol•L-1的醋酸中由水电离的c(H+)=10-11mol•L-1 | |
| B. | Na2CO3溶液中存在c(Na+)+c(H+)═c(OH-)+a c(X)+b c(Y),若X为HCO3-,则b=2 | |
| C. | 某温度下,浓度均为0.01mol•L-1的盐酸和氢氧化钠溶液的pH分别为2和12 | |
| D. | 向0.1mol•L-1氯化铵溶液滴加几滴浓盐酸,c(NH4+)减小,PH增大 |
分析 A.醋酸为弱酸部分电离;
B.根据电荷守恒分析;
C.温度不知道,则Kw的数据不知,无法计算NaOH溶液的pH;
D.加浓盐酸,氢离子浓度增大.
解答 解:A.醋酸为弱酸部分电离,醋酸中氢离子浓度小于0.001 mol•L-1,则氢氧根离子的浓度大于10-11mol•L-1,所以c(H+)>10-11mol•L-1,故A错误;
B.Na2CO3溶液中存在电荷守恒:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+2 c(CO32-),若X为HCO3-,则b=2,故B正确;
C.温度不知道,则Kw的数据不知,氢氧化钠溶液中c(H+)=$\frac{Kw}{c(O{H}^{-})}$,所以无法计算NaOH溶液的pH,故C错误;
D.向0.1mol•L-1氯化铵溶液滴加几滴浓盐酸,抑制铵根离子的水解,则c(NH4+)增大,加浓盐酸,氢离子浓度增大,pH减小,故D错误.
故选B.
点评 本题考查了盐的水解、溶液中离子浓度的计算,题目难度不大,注意酸、碱、盐溶液中氢离子和氢氧根离子的计算方法.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
4.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,22.4 LSO3所含电子数约为40 NA | |
| B. | 0.5 mol NH4HSO4晶体中,含有H+数目约为0.5 NA | |
| C. | 92 g NO2、N2O4混合气体含有的N原子数为2NA | |
| D. | 1 mol Cl2作为氧化剂得到的电子数为NA |
5.下列叙述正确的是( )
| A. | Na、C、P、S分别在足量氧气中燃烧均生成一种相应氧化物:Na2O2、CO2、P2O5、SO3 | |
| B. | 稀硝酸、稀硫酸均能将木炭氧化成二氧化碳,浓硝酸、浓疏酸都能使铁、铝钝化 | |
| C. | 欲鉴别NO2、Br2(g)两种红棕色气体,将两种待测气体分別通入AgNO3溶液中 | |
| D. | 将久置于空气中的Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变为红色,说 明Fe(NO3)2样品在空气中已变质 |
2.下列说法不正确的是( )
| A. | 油脂是油和脂肪的统称,都是高级脂肪酸与甘油形成的酯 | |
| B. | 棉花、羊毛、蚕丝和麻等是天然纤维 | |
| C. | 高聚物 中的官能团是酯基 中的官能团是酯基 | |
| D. | 可以用溴水鉴别乙醛和乙烯 |
19.栀子花具有浓郁的香味是因为栀子酯,其结构简式如图,下列说法正确的是( )


| A. | 该栀子酯的分子式C10H11O2 | |
| B. | 1mol栀子酯水解需要消耗2mol NaOH | |
| C. | 栀子酯可以发生加成、取代和消去反应 | |
| D. | 栀子酯的一氯代物有六种 |
6.运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义.
(1)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ/mol.在T1℃时,反应进行到不同时间(min)测得各物质的浓度(mol/L)如下:
①30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是ad (填字母编号).
a.通入一定量的NO b.加入一定量的活性炭 c.加入合适的催化剂 d.适当缩小容器的体积
②若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q<0(填“>”或“<”).
(2)某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如1图所示,利用以下反应:NO+CO?N2+CO2(有CO),2NO?N2+O2(无CO)

①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为该反应是放热反应,升高温度反应更有利于向逆反应方向进行;在n(NO)/n(CO)=1的条件下,应控制最佳温度在870℃左右.
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染.写出C2H6与NO2发生反应的化学方程式4C2H6+14NO2$\frac{\underline{\;催化剂\;}}{\;}$8CO2+7N2+12H2O.
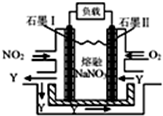
③以NO2、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,则该电极反应式为NO2+NO3--e-=N2O5.
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)?2CO(g)+2H2(g).
①在密闭容器中通入物质的量浓度均为0.1mol•L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图2所示,则压强P1小于 P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)大于v(逆)(填“大于”、“小于”或“等于”).
②天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X.由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图3,则X的结构简式为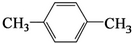 .
.
(1)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ/mol.在T1℃时,反应进行到不同时间(min)测得各物质的浓度(mol/L)如下:
时间 浓度 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
a.通入一定量的NO b.加入一定量的活性炭 c.加入合适的催化剂 d.适当缩小容器的体积
②若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q<0(填“>”或“<”).
(2)某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如1图所示,利用以下反应:NO+CO?N2+CO2(有CO),2NO?N2+O2(无CO)

①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为该反应是放热反应,升高温度反应更有利于向逆反应方向进行;在n(NO)/n(CO)=1的条件下,应控制最佳温度在870℃左右.
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染.写出C2H6与NO2发生反应的化学方程式4C2H6+14NO2$\frac{\underline{\;催化剂\;}}{\;}$8CO2+7N2+12H2O.
③以NO2、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,则该电极反应式为NO2+NO3--e-=N2O5.

(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)?2CO(g)+2H2(g).
①在密闭容器中通入物质的量浓度均为0.1mol•L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图2所示,则压强P1小于 P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)大于v(逆)(填“大于”、“小于”或“等于”).
②天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X.由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图3,则X的结构简式为
 .
. 
 .
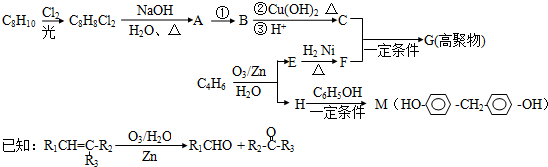
.
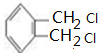
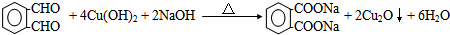
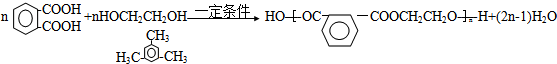
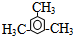 .
.