题目内容
3.无机盐X在医药、化工、农业等领域都有广泛用途,工业上一般通过单质甲与Ca(OH)2浊液共热的方法来制备.经测定,X中含有两种元素,相对质量为168;取8.40gX与足量盐酸反应,产物中有0.15mol单质甲和1.12L气体乙(已折算成标准状况).已知气体乙在标准状况下的密度约为1.52g•L-1,在O2中燃烧得到无色、刺激性气味气体丙,丙是一种常见的大气污染物.请回答下列问题:(1)X的化学式为CaS4,乙的电子式为
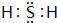 .
.(2)X与足量盐酸反应的化学方程式为CaS4+2HCl=CaCl2+3S↓+H2S↑.
(3)气体丙与碘水反应的离子方程式为SO2+I2+2H2O=4H++2I-+SO42-.
(4)Ca(OH)2浊液与甲共热是否只生成X和水?并说明理由否,根据氧化还原反应规律,产物中氯元素的价态不可能只降低不升高.
(5)实验室用过量NaOH溶液吸收丙时,生成产物丁,丁中可能混有组成元素完全相同的另一种盐戊,轻设计实验方案验证戊是否存在?取少量实验结束后的溶液少许于试管中,先加入足量盐酸酸化,再滴加几滴BaCl2溶液,若出现白色沉淀,证明存在Na2SO4,反之则无.
分析 气体乙在标准状况下的密度约为1.52g•L-1,Mr(乙)=22.4×1.52=34,在O2中燃烧得到无色、刺激性气味气体丙,丙是一种常见的大气污染物,可推知乙为H2S、丙为SO2,由元素守恒可知单质甲为S,X中含有两种元素,为Ca、S两种元素,其相对质量为168,8.40gX的物质的量为$\frac{8.4g}{168g/mol}$=0.05mol,与足量盐酸反应得到0.15molS,得到硫化氢为$\frac{1.12L}{22.4L/mol}$=0.05mol,则1molX含有S原子为4mol,含有Ca原子为$\frac{168-32×4}{40}$mol=1mol,故X的化学式为CaS4,据此解答.
解答 解:气体乙在标准状况下的密度约为1.52g•L-1,Mr(乙)=22.4×1.52=34,在O2中燃烧得到无色、刺激性气味气体丙,丙是一种常见的大气污染物,可推知乙为H2S、丙为SO2,由元素守恒可知单质甲为S,X中含有两种元素,为Ca、S两种元素,其相对质量为168,8.40gX的物质的量为$\frac{8.4g}{168g/mol}$=0.05mol,与足量盐酸反应得到0.15molS,得到硫化氢为$\frac{1.12L}{22.4L/mol}$=0.05mol,则1molX含有S原子为4mol,含有Ca原子为$\frac{168-32×4}{40}$mol=1mol,故X的化学式为CaS4.
(1)X的化学式为CaS4,乙为H2S,电子式为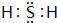 ,
,
故答案为:CaS4;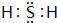 ;
;
(2)CaS4与足量盐酸反应生成CaCl2、S、H2S,且S、H2S的物质的量之比为3:1,反应的化学方程式为:CaS4+2HCl=CaCl2+3S↓+H2S↑,
故答案为:CaS4+2HCl=CaCl2+3S↓+H2S↑;
(3)丙为SO2,与碘水反应生成HI与硫酸,反应的离子方程式为:SO2+I2+2H2O=4H++2I-+SO42-,
故答案为:SO2+I2+2H2O=4H++2I-+SO42-;
(4)根据氧化还原反应规律,产物中氯元素的价态不可能只降低不升高,故Ca(OH)2浊液与S共热是否只生成CaS4和水,
故答案为:否,根据氧化还原反应规律,产物中氯元素的价态不可能只降低不升高;
(5)实验室用过量NaOH溶液吸收SO2时,生成产物为Na2SO3,由于Na2SO3易被氧化为Na2SO4,即丁中可能混有的盐戊为Na2SO4,检验其存在的方法为:取少量实验结束后的溶液少许于试管中,先加入足量盐酸酸化,再滴加几滴BaCl2溶液,若出现白色沉淀,证明存在Na2SO4,反之则无,
故答案为:取少量实验结束后的溶液少许于试管中,先加入足量盐酸酸化,再滴加几滴BaCl2溶液,若出现白色沉淀,证明存在Na2SO4,反之则无.
点评 本题考查无机物推断,属于计算型推断,是对学生综合能力的考查,需要学生熟练掌握元素化合物知识,较好的考查学生分析计算、推理能力,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 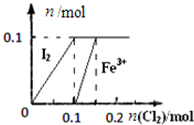 表示向100mL1 mol•L-1 FeI2溶液中逐渐通入Cl2,I2和Fe3+物质的量变化关系 | |
| B. | 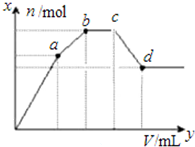 表示向100mL 0.1 mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol•L-1 Ba(OH)2溶液,沉淀物质的量变化的关系 | |
| C. |  表示在不同温度下,水溶液中c(H+)与c(OH-)变化关系 | |
| D. |  得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右 |
| A. | 室温下,0.001 mol•L-1的醋酸中由水电离的c(H+)=10-11mol•L-1 | |
| B. | Na2CO3溶液中存在c(Na+)+c(H+)═c(OH-)+a c(X)+b c(Y),若X为HCO3-,则b=2 | |
| C. | 某温度下,浓度均为0.01mol•L-1的盐酸和氢氧化钠溶液的pH分别为2和12 | |
| D. | 向0.1mol•L-1氯化铵溶液滴加几滴浓盐酸,c(NH4+)减小,PH增大 |
| A. | 已知X在一定条件下转化为Y,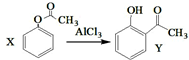 ,X与Y互为同系物,可用FeBr3溶液鉴别 ,X与Y互为同系物,可用FeBr3溶液鉴别 | |
| B. | 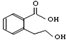 能发生的反应类型有:加成反应、取代反应、消去反应、氧化反应 能发生的反应类型有:加成反应、取代反应、消去反应、氧化反应 | |
| C. | 3-甲基-3-乙基戊烷的一氯取代产物有5种 | |
| D. | 相同条件下乙酸乙酯在水中的溶解度比在乙醇中的溶解度要大 |
 利用如图装置可以制取某些气体,所用药品合理且收集气体方法正确的是( )
利用如图装置可以制取某些气体,所用药品合理且收集气体方法正确的是( )| 制取气体 | 实验药品 | 收集气体方法 | |
| A | 二氧化碳 | 碳酸钙、稀硫酸 | 排饱和碳酸氢钠溶液 |
| B | 氧气 | 双氧水、二氧化锰 | 排水法 |
| C | 氨气 | 氧氡化钠溶液、浓氨水 | 向下排空气法 |
| D | 乙烯 | 氯乙烷,氢氧化钠、乙醇 | 排水法 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
| A. | 在氯乙烷中直接加入AgNO3溶液 | |
| B. | 加蒸馏水,充分搅拌后,加入AgNO3溶液 | |
| C. | 加入NaOH溶液,加热,然后加入AgNO3溶液 | |
| D. | 加入热的NaOH醇溶液,充分反应后,加入稀硝酸酸化,再加入AgNO3溶液 |

| A. | 当溶液的pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3•H2O)>c(CO32-) | |
| B. | NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3•H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3) | |
| C. | 往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小 | |
| D. | 通过分析可知常温下Kb(NH3•H2O)>Ka1(H2CO3) |
| A. | 若A遇NaHCO3溶液有气体生成,则A的结构共有4种 | |
| B. | 若A遇稀硫酸能生成两种有机物,则A的结构共有4种 | |
| C. | 若A能发生银镜反应,则A的结构有2种 | |
| D. | 若A既能和新制Cu(OH)2反应产生砖红色沉淀,又能和金属钠反应放出H2,则A的结构有3种 |
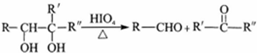
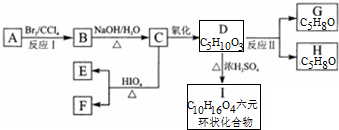
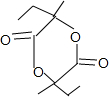 +2H2O.
+2H2O.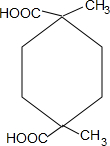 .
.