题目内容
3.25℃时,pH=3的一元弱酸HA与pH=11的一元强碱ROH等体积混合后,溶液中各离子浓度的关系正确的是( )| A. | c(A-)>c(R+)>c(H+)>c(OH-) | B. | c(A-)>c(R+)>c(OH-)>c(H+) | ||
| C. | c(R+)>c(A-)>c(H+)>c(OH-) | D. | c(R+)>c(A-)>c(OH-)>c(H+) |
分析 25℃时,pH=3的一元弱酸HA浓度大于pH=11的一元强碱ROH,二者等体积混合后溶液中溶质为RA和HA,且HA电离程度大于RA水解程度导致溶液呈酸性,溶液中存在电荷守恒,据此分析解答.
解答 解:25℃时,pH=3的一元弱酸HA浓度大于pH=11的一元强碱ROH,二者等体积混合后溶液中溶质为RA和HA,且HA电离程度大于RA水解程度导致溶液呈酸性,则c(H+)>c(OH-),结合电荷守恒得c(A-)>c(R+),HA电离程度较小,则溶液中离子浓度大小顺序是c(A-)>c(R+)>c(H+)>c(OH-),
故选A.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质成分及其性质是解本题关键,注意电荷守恒的灵活运用,侧重考查学生比较判断能力,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.下列说法中不正确的是( )
| A. | 用稀AgNO3溶液洗涤AgCl沉淀比用水洗涤损耗AgCl小 | |
| B. | 对于Al(OH)3(s)?Al(OH)3(aq)?Al3++3OH-,前者为溶解平衡,后者为电离平衡 | |
| C. | 已知AgCl的 KSP=1.8×10-10,将AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) | |
| D. | 将KI溶液加入到AgCl的饱和溶液中,产生黄色沉淀,说明AgCl溶解度大于AgI |
8.将ag Na放入水中,完全反应后要使所得溶液中每b个水分子中溶有1个Na+,需水的量为( )
| A. | $\frac{ab}{23}$mol | B. | $\frac{a(b+1)}{23}$mol | C. | $\frac{18ab}{23}$g | D. | $\frac{18a(b+1)}{23}$mol |
12.某混合物,可能含有以下几种离子:K+、Cl-、NH4+、Mg2+、CO32-、Ba2+、SO42-,若将该混合物溶于水可得澄清溶液,现取3份各100mL该溶液分别进行如下实验:
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是不能确定(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断混合物中一定不存在的离子是Ba2+、Mg2+.
(2)试确定溶液中一定存在的阴离子及其物质的量浓度((可以不填满,也可以增加)):
(3)试确定K+是否存在?存在,如果存在,c(K+)溶液中肯定存在的离子是NH4+、CO32-和SO42-,经计算,NH4+的物质的量为0.05 mol,CO32-、SO42-的物质的量分别为0.01 mol和0.02 mol,根据电荷守恒得K+一定存在,且钾离子的物质的量浓度为:≥0.1mol/l,如果不存在,理由是、.
| 实验 序号 | 实验内容 | 实验结果 |
| 1 | 加AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
| 3 | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.63g,第二次称量读数为4.66g |
(1)根据实验1对Cl-是否存在的判断是不能确定(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断混合物中一定不存在的离子是Ba2+、Mg2+.
(2)试确定溶液中一定存在的阴离子及其物质的量浓度((可以不填满,也可以增加)):
| 阴离子符号 | 物质的量浓度(mol/L) |
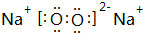 .
.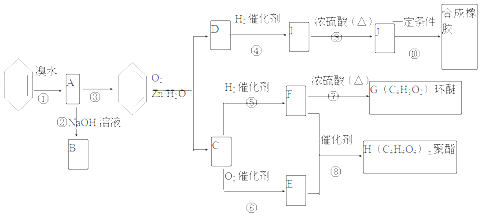
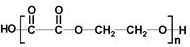
 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaBr.C与足量银氨溶液反应的化学方程式OHC-CHO+4[Ag(NH3)2]OH
+2NaBr.C与足量银氨溶液反应的化学方程式OHC-CHO+4[Ag(NH3)2]OH H4NOOCCOONH4+4Ag↓+6NH3+2H2O
H4NOOCCOONH4+4Ag↓+6NH3+2H2O