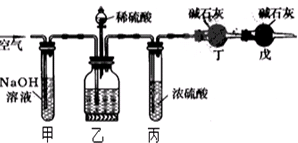
题目内容
14.实验室配制490mL 0.2mol•L-1NaOH溶液,回答下列问题(1)应用托盘天平称取氢氧化钠固体4.0g.
(2)配制NaOH溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、500ml容量瓶、胶头滴管.使用容量瓶前必须进行的操作是查漏.
(3)配制时,该实验两次用到玻璃棒,其作用分别是搅拌、引流.
(4)定容时若加水超过刻度线,应如何处理?重新配制.
(5)试分析下列操作对所配溶液的浓度有何影响.
A、偏高 B、偏低 C、不变(用符号回答)
①定容时俯视刻度线A;
②放在滤纸上称量NaOH固体B.
③定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度:B.
分析 (1)由于无490mL的容量瓶,故选用500mL的容量瓶,配制出500mL的0.2mol/L的溶液,根据n=cV和m=nM来计算需要氢氧化钠固体质量,称量固体应该用托盘天平,精确度为0.1g;
(2)根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器,量瓶带有磨口玻璃活塞,配制溶液过程中需要容量瓶需要倒立振荡摇匀溶液,玻璃活塞处不能漏水;
(3)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,该实验两次用到玻璃棒分别为,溶解和转移,据此分析玻璃杯的作用;
(4)错误的操作发生后,能补救的就补救,不能补救的则重新配制;
(5)根据C=$\frac{n}{V}$,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差.
解答 解:(1)由于无490mL的容量瓶,故选用500mL的容量瓶,配制出500mL的0.2mol/L的溶液,故需要的氢氧化钠的物质的量n=cV=0.2mol/L×0.5L=0.1mol,质量m=nM=0.1mol×40g/mol=4.0g,
故答案为:4.0;
(2)操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、500mL容量瓶、胶头滴管,容量瓶带有磨口玻璃活塞,配制溶液过程中需要容量瓶需要倒立振荡摇匀溶液,玻璃活塞处不能漏水,使用容量瓶前必须进行的操作是检查是否漏液,
故答案为:500ml容量瓶,胶头滴管,查漏;
(3)操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,其中在烧杯中溶解溶质固体,并用玻璃棒搅拌,是加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移溶液,
故答案为:搅拌,引流;
(4)若配制时,因加水不慎略超过了容量瓶刻度线,此失误无法补救,只能重新配置,
故答案为:重新配制;
(5)根据C=$\frac{n}{V}$,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析,
①定容时俯视容量瓶刻度线,导致V偏小,则配制溶液浓度偏高;
②在天平托盘上垫纸,将NaOH放在纸上称量,氢氧化钠易潮解,则导致真正的氢氧化钠的质量偏小,则溶液的浓度偏低;
③摇匀后发现液面低于刻度线,继续滴加蒸馏水至刻度线后再摇匀,溶液的体积偏大,配制溶液浓度偏低;
上述分析可知,①选A,②选B,③选B,
故答案为:A、B、B;
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算、仪器使用和作用、误差分析,属于基础型题目,难度不大.

| A. | 在标准状况下,1L的密闭容器中恰好可盛放n个N2分子和m个H2分子组成的混合气体,则阿伏伽德罗常数NA可近似表示为$\frac{m+n}{22.4}$mol-1 | |
| B. | 标准状况下,32g O3和O2的混合气体中,含有氧原子数一定为2NA | |
| C. | 等体积、等浓度的磷酸溶液和盐酸溶液,其溶液中含有的氢元素质量之比一定为3:1 | |
| D. | 等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比一定为2:6 |
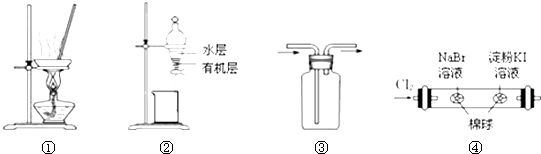
| A. | 用图①所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| B. | 用图②所示装置,分离CCl4萃取碘水后的有机层和水层 | |
| C. | 按装置③所示的气流方向可用于收集H2、NH3等 | |
| D. | 用图④所示装置,可以证明氧化性:Cl2>Br2>I2 |
| A. | 常温常压下,16gCH4含有10NA个电子 | |
| B. | 0.1mol•L-1的盐酸溶液中含有0.1NA个H+ | |
| C. | 1molNa与乙醇完全反应,失去2NA个电子 | |
| D. | 标准状况下,22.4L苯含有NA个苯分子 |
| A. | 该溶液呈浅绿色 | |
| B. | 该溶液中加入NaOH溶液,生成白色沉淀并迅速变成灰绿色,最后变为红褐色 | |
| C. | 向该溶液中加入氯水,再滴入几滴KSCN溶液,呈红色 | |
| D. | 向该溶液中滴入几滴KSCN溶液,不变色,再加入氯水,呈红色 |