题目内容
12.下列有关说法不正确的是( )| A. | 常温下Cu与浓硫酸不反应,是因为发生了钝化 | |
| B. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| C. | FeCl2、NaHSO3、Fe(OH)3均能通过化合反应直接制得 | |
| D. | NH4HCO3、NH4Cl、I2受热后均无固体剩余 |
分析 A.铜性质不活泼常温下不能与浓硫酸反应;
B.Fe(OH)3胶体的制备方法是:向沸水中滴加少量饱和氯化铁溶液,加热至溶液呈红褐色即可;
C.氯化铁与铁化合生成氯化亚铁,亚硫酸钠与二氧化硫和水生成亚硫酸氢钠,氢氧化亚铁与氧气、水化合生成氢氧化铁;
D.碳酸氢铵受热分解生成氨气、二氧化碳和水,氯化铵受热分解生成氨气和氯化氢,碘受热升华成碘蒸汽.
解答 解:A.常温下Cu与浓硫酸不反应是因为铜性质不活泼,不是发生钝化,故A错误;
B.Fe(OH)3胶体的制备方法是:向沸水中滴加少量饱和氯化铁溶液,加热至溶液呈红褐色即可,所以向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体,故B正确;
C.氯化铁与铁化合生成氯化亚铁,亚硫酸钠与二氧化硫和水生成亚硫酸氢钠,氢氧化亚铁与氧气、水化合生成氢氧化铁,故C正确;
D.碳酸氢铵受热分解生成氨气、二氧化碳和水,氯化铵受热分解生成氨气和氯化氢,碘受热升华成碘蒸汽,所以NH4HCO3、NH4Cl、I2受热后均无固体剩余,故D正确;
故选:A.
点评 本题考查了元素化合物知识,熟悉相关物质的性质是解题关键,注意氢氧化铁胶体制备方法,题目难度不大.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
7.铅、二氧化铅、氟硼酸(HBF4)电池是一种低温性能优良的电池,常用于军事和国防工业,其总反应方程式为Pb+PbO2+4HBF4$?_{充电}^{放电}$2Pb(BF4)2+2H2O[已知:HBF4、Pb(BF4)2均是易溶于水的强电解质].下列说法中不正确的是( )
| A. | 充电时,阳极附近溶液的pH增大 | |
| B. | 充电时,阴极的电极反应式为pb2++2e-═pb | |
| C. | 放电时,转移1mol电子时负极减少的质量为103.5g | |
| D. | 放电时,正极的电极反应式为PbO2+2e-+4H+═pb2++2H2O |
17.在芳香族化合物中,由于侧链与苯环间的相互影响,从而使它们在性质上都发生了一些变化.下列反应中能够说明这一现象的是( )
| A. |  | |
| B. | 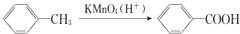 | |
| C. | 甲苯和乙烷在空气中完全燃烧,生成相同的产物 | |
| D. | 甲苯和乙烷都不能与溴的四氯化碳溶液发生反应 |
4.某学生配置0.1mol.L-1的NaOH溶液480mL,下列说法正确的是( )
| A. | 选用480 mL 容量瓶 | |
| B. | 把烧碱固体放在纸上称量 | |
| C. | 把称好的固体放入容量瓶中稀释至刻度线 | |
| D. | 定容时俯视容量瓶的刻度线浓度偏大 |
1.下面关于Na2CO3与NaHCO3的叙述错误的是( )
| A. | NaHCO3加热分解转化为Na2CO3 | |
| B. | 在水中的溶解度:Na2CO3比NaHCO3大 | |
| C. | 与同浓度的稀硫酸反应时,Na2CO3比NaHCO3剧烈 | |
| D. | NaHCO3能与NaOH反应,而Na2CO3不能 |
2.已知反应2A(g)?2B(g)+C(s),某温度下的平衡常数为4,此温度下,在2L的密闭容器中加入amolA,反应到某时刻测得各组分的浓度如表,则下列说法中正确的是( )
| 物质 | A | B |
| 浓度/(mol•L-1) | 0.4 | 0.6 |
| A. | a=1.0 | |
| B. | 此时刻正反应速率小于逆反应速率 | |
| C. | 在相同条件下,若起始时加入2amolA,则达到平衡时A的转化率减小 | |
| D. | 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态 |