题目内容
2.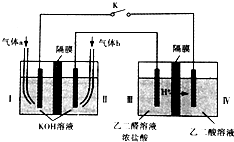 乙醛酸(HOOC-CHO)是有机合成的重要中间体.某同学组装了下图所示的电化学装置,电极材料Ⅰ~Ⅳ均为石墨,左池为氢氧燃料电池,右池为用“双极室成对电解法”生产乙醛酸,关闭K后,两极室均可产生乙醛酸,其中乙二醛与Ⅲ电极的产物反应生成乙醛酸.下列说法不正确的是( )
乙醛酸(HOOC-CHO)是有机合成的重要中间体.某同学组装了下图所示的电化学装置,电极材料Ⅰ~Ⅳ均为石墨,左池为氢氧燃料电池,右池为用“双极室成对电解法”生产乙醛酸,关闭K后,两极室均可产生乙醛酸,其中乙二醛与Ⅲ电极的产物反应生成乙醛酸.下列说法不正确的是( )| A. | 电极Ⅱ上的电极反应式:O2+4e-+2H2O═4OH- | |
| B. | 电极Ⅳ上的电极反应式:HOOC-COOH+2e-+2H+═HOOC-CHO+H2O | |
| C. | 乙二醛与Ⅲ电极的产物反应生成乙醛酸的化学方程式:Cl2+OHC-CHO+H2O=2HCl+HOOC-CHO | |
| D. | 若有2 mol H+ 通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1 mol |
分析 左池为氢氧燃料电池,右池为用“双极室成对电解法”生产乙醛酸,关闭K后,两极室均可产生乙醛酸,其中乙二醛与Ⅲ电极的产物反应生成乙醛酸,即电极Ⅲ的产物是氯气,发生反应:Cl2+OHC-CHO+H2O=2HCl+HOOC-CHO,所以电极Ⅲ是阳极,所以电极Ⅱ是燃料电池的正极,电极Ⅰ负极,根据电极反应式结合电子守恒进行计算即可.
解答 解:左池为氢氧燃料电池,右池为用“双极室成对电解法”生产乙醛酸,关闭K后,两极室均可产生乙醛酸,其中乙二醛与Ⅲ电极的产物反应生成乙醛酸,即电极Ⅲ的产物是氯气,发生反应:Cl2+OHC-CHO+H2O=2HCl+HOOC-CHO,所以电极Ⅲ是阳极,所以电极Ⅱ是燃料电池的正极,电极Ⅰ负极,
A、电极Ⅲ是阳极,所以电极Ⅱ是燃料电池的正极,电极Ⅰ负极,左池为氢氧燃料电池,碱性环境下,电极Ⅱ正极上的电极反应式:O2+4e-+2H2O═4OH-,故A正确;
B、电极Ⅲ是阳极,电极Ⅳ是阴极,两极上都产生乙醛酸,所以Ⅳ电极上发生反应的电极反应式:HOOC-COOH+2e-+2H+═HOOC-CHO+H2O,故B正确;
C、电极Ⅲ是阳极,产生氯气,乙二醛与Ⅲ电极的产物反应生成乙醛酸的化学方程式:Cl2+OHC-CHO+H2O=2HCl+HOOC-CHO,故C正确;
D、2mol H+通过质子交换膜,则电池中转移2mol电子,根据电极方程式HOOC-COOH+2e-+2H+═HOOC-CHO+H2O,可知生成1mol乙醛酸,由于两极均有乙醛酸生成所以生成的乙醛酸为2mol,故D错误.
故选D.
点评 本题考查了电解池原理的分析应用,把握电解池原理以及电解过程中电子守恒的计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.对下列污染现象叙述正确的是( )
| A. | 臭氧空洞的形成主要与SO2有关 | |
| B. | 酸雨的形成主要与SO2有关 | |
| C. | 光化学烟雾的形成主要与NO2等有关 | |
| D. | 水体富营养化的形成主要与含氮、磷污水的排放有关 |
13.化学与生产、生活、社会密切相关.下列说法中不正确的是( )
| A. | 蛋白质、棉花、PVC、淀粉都是混合物 | |
| B. | 废弃的玻璃、金属、纸制品是可回收利用的资源 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
10.下列有关实验操作,不正确的是( )
| A. | 用新制氢氧化铜检验牙膏中的甘油,现象是看到产生蓝色沉淀 | |
| B. | 为了使过饱和溶液中析出晶体,可用玻璃棒摩擦与溶液接触处的试管壁 | |
| C. | 做银镜反应实验后,试管内壁上的附着物用稀硝酸洗涤 | |
| D. | 用纸层析法分离Fe3+、Cu2+时,滤纸上的水做固定相,氨气做显色剂 |
17.下列说法正确的是( )
| A. | 硫酸亚铁铵晶体过滤后用无水乙醇洗涤,阿司匹林晶体过滤后用冷水洗涤 | |
| B. | 最简式为C2H4O的有机物一定可以发生银镜反应 | |
| C. | 不粘锅表面的高分子涂层可以由四氟乙烯通过缩聚反应合成 | |
| D. | 甘油和甲苯只有在物质的量之比1:1混合时,充分燃烧后生成的水,才与等质量的甘油充分燃烧后生成的水相同 |
11.某同学设计了由乙醇合成乙二醇的路线如下.下列说法正确的是( )
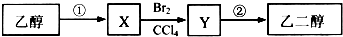
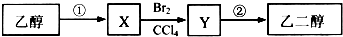
| A. | 步骤①的反应类型是氧化反应 | |
| B. | 等物质的量的乙醇、乙二醇完全燃烧,消耗氧气的量相同 | |
| C. | 1 mol乙二醇与乙酸若完全发生酯化反应,理论上可以增重120g | |
| D. | X可以使酸性高锰酸钾溶液褪色 |
 ;
;