题目内容
(1)等质量的O2和O3所含分子个数比为 ,原子个数比为 .
(2)等温等压下,等体积的SO2和SO3所含分子个数比为 ,质量比为 .
(3)2mol OH-含有的电子数为 NA.3g R2O4含有0.1mol氧原子,则R的相对原子量为 .
(4)反应 2KMnO4+16HCl=2MnCl2+2KCl+5Cl2+8H2O中,氧化剂是 ,氧化产物是 (填化学式).若生成71g Cl2 ,则消耗的HCl是 mol.
(5)将16mol?L-1的浓硫酸稀释成4mol?L-1的稀硫酸100mL,需要浓硫酸 mL.
(2)等温等压下,等体积的SO2和SO3所含分子个数比为
(3)2mol OH-含有的电子数为
(4)反应 2KMnO4+16HCl=2MnCl2+2KCl+5Cl2+8H2O中,氧化剂是
(5)将16mol?L-1的浓硫酸稀释成4mol?L-1的稀硫酸100mL,需要浓硫酸
考点:氧化还原反应的计算,物质的量的相关计算
专题:计算题
分析:根据n=
=
=
=cV结合物质的构成计算该题,(4)从元素化合价的角度解答.
| m |
| M |
| N |
| NA |
| V |
| Vm |
解答:
解:(1)O2和O3都与O元素构成,则等质量时,原子个数相同,由分子式可知分子数之比为3:2,
故答案为:3:2;1:1;
(2)等温等压下,气体的Vm相等,由n=
可知,气体的物质的量相等,则分子数相等,质量比为64:80=4:5,
故答案为:1:1;4:5;
(3)1个OH-中含有10个电子,2mol OH-含有的电子数为20NA,3g R2O4含有0.1mol氧原子,则n(R2O4)=0.025mol,M(R2O4)=120g/mol,M(R)=
=28,
故答案为:20;28;
(4)反应2KMnO4+16HCl=2MnCl2+2KCl+5Cl2+8H2O中,Mn元素化合价降低,被还原,KMnO4为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,
n(Cl2)=
=1mol,由方程式可知消耗盐酸的物质的量为
=3.2mol,
故答案为:KMnO4;Cl2;3.2;
(5)设浓硫酸体积为VL,
则16mol/L×VL=4mol/L×0.1L,
V=0.025L=25mL,
故答案为:25.
故答案为:3:2;1:1;
(2)等温等压下,气体的Vm相等,由n=
| V |
| Vm |
故答案为:1:1;4:5;
(3)1个OH-中含有10个电子,2mol OH-含有的电子数为20NA,3g R2O4含有0.1mol氧原子,则n(R2O4)=0.025mol,M(R2O4)=120g/mol,M(R)=
| 120-4×16 |
| 2 |
故答案为:20;28;
(4)反应2KMnO4+16HCl=2MnCl2+2KCl+5Cl2+8H2O中,Mn元素化合价降低,被还原,KMnO4为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,
n(Cl2)=
| 71g |
| 71g/mol |
| 16 |
| 5 |
故答案为:KMnO4;Cl2;3.2;
(5)设浓硫酸体积为VL,
则16mol/L×VL=4mol/L×0.1L,
V=0.025L=25mL,
故答案为:25.
点评:本题考查较为综合,涉及氧化还原反应以及物质的量的相关计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意相关计算公式的运用,难度中等.

练习册系列答案
相关题目
在同温同压下,下列各组热化学方程式中 Q2>Q1的是( )
| A、2H2(g)+02(g)=2H20(g);△H1=-Q1 2H2(g)+02(g)=2H20(1);△H2=-Q2 | ||||
| B、S(g)+O2(g)=S02(g);△H1=-Q1 S(s)+02(g)=S02(g);△H2=-Q2 | ||||
C、C(s)+
C(s)+02(g)=C02(g);△H2=-Q2 | ||||
D、H2(g)+Cl2(g)=2HCl(g);△H1=-Q1
|
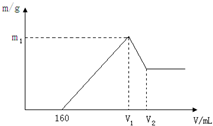 将镁铝的混合物0.1mol溶于100mL 2mol?L-1硫酸溶液中,然后再滴加1mol?L-1氢氧化钠溶液,请回答以下问题:
将镁铝的混合物0.1mol溶于100mL 2mol?L-1硫酸溶液中,然后再滴加1mol?L-1氢氧化钠溶液,请回答以下问题: :
: :
: :
: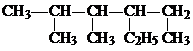 的名称是
的名称是 化合物A中含氧官能团的名称
化合物A中含氧官能团的名称