题目内容
现有铝和过氧化钠的固体混合物样品,加入稀硫酸使混合物完全溶解,所得溶液中 c(Al3+):c(SO42):c(H+)=1:4:2,则原固体混合物中铝元素与氧元素的质量比为( )
| A、1:3 | B、3:4 |
| C、9:8 | D、9:16 |
考点:有关混合物反应的计算
专题:计算题
分析:溶液中离子浓度之比物质的量之比,设n(Al3+)、n(SO42-)、n(H+)分别为1mol、4mol、2mol,根据反应后溶液中含有H+,则加入的硫酸过量,溶液中的溶质为硫酸钠、硫酸铝、硫酸,根据电荷守恒得:n(H+)+n(Na+)+3n(Al3+)=2n(SO42-),据此计算n(Na+),根据钠元素守恒计算n(Na2O2),进而计算n(O),再利用m=nM计算铝元素与氧元素的质量,据此计算原固体混合物中铝元素与氧元素的质量比.
解答:
解:根据反应后溶液中含有H+,知加入的硫酸过量,溶液中的溶质为硫酸钠、硫酸铝、硫酸,
根据电荷守恒得:n(H+)+n(Na+)+3n(Al3+)=2n(SO42-),
溶液中离子浓度之比物质的量之比,n(Al3+)、n(SO42-)、n(H+)分别为1mol、4mol、2mol,故n(Na+)=4mol×2-1mol×3-1mol×2=3mol,
根据钠元素守恒计算n(Na2O2)=3mol×
=1.5mol,
则Al元素、O元素的质量比为:1mol×27g/mol:1.5mol×2×16g/mol=9:16,
故选D.
根据电荷守恒得:n(H+)+n(Na+)+3n(Al3+)=2n(SO42-),
溶液中离子浓度之比物质的量之比,n(Al3+)、n(SO42-)、n(H+)分别为1mol、4mol、2mol,故n(Na+)=4mol×2-1mol×3-1mol×2=3mol,
根据钠元素守恒计算n(Na2O2)=3mol×
| 1 |
| 2 |
则Al元素、O元素的质量比为:1mol×27g/mol:1.5mol×2×16g/mol=9:16,
故选D.
点评:本题考查Al、Na单质及化合物性质、混合物的有关计算等,题目难度中等,注意掌握有关混合物计算的方法,解答关键是利用电荷守恒判断溶液中钠离子的量.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
化学与生活、社会密切相关.下列说法错误的是( )
| A、发展低碳经济、循环经济,推广可利用太阳能、风能的城市照明系统 |
| B、含磷洗衣粉中的磷是植物生长的营养元素,洗衣水可排入河泊 |
| C、在入海口的钢铁闸门上装一定数量的锌块可防止闸门被腐蚀 |
| D、国家规定商家不得无偿提供塑料袋,是为了减少白色污染 |
下列操作不能达到目的是( )
| A、将25g CuSO4?5H2O溶于100 mL蒸馏水中,配制100mol l.0 mol/LCuSO4溶液 |
| B、检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的红色石蕊试纸检验逸出的气体 |
| C、用加热分解的方法区分碳酸钠和碳酸氢钠两种固体 |
| D、用银氨溶液鉴别葡萄糖和蔗糖 |
我国自主研制可治疗H7N9禽流感新药帕拉米韦,结构如图.下列有关说法正确的是( )

| A、该有机物的分子式是C15H27O4N4 |
| B、该分子中含有氨基、羧基、羟基、醛基等官能团 |
| C、该分子不仅具有两性,还能发生水解反应和酯化反应 |
| D、该分子中含有5个手性碳原子 |
 肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图,已知断裂1mol化学键所需的能量(kJ):N≡N为942、N-H为391、O=O为500,则断裂1molN-N键所需的能量(kJ)是( )
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图,已知断裂1mol化学键所需的能量(kJ):N≡N为942、N-H为391、O=O为500,则断裂1molN-N键所需的能量(kJ)是( )| A、1327 | B、391 |
| C、516 | D、154 |
某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:方案一:铜铝混合物
测定生成气体的体积方案二:铜铝混合物
测定剩余固体的质量下列有关判断中不正确的是( )
| 足量溶液A |
| 充分反应 |
| 足量溶液B |
| 充分反应 |
| A、溶液A和溶液B均可以是盐酸或NaOH溶液 |
| B、方案一可能产生氢气,方案二可能剩余铜 |
| C、若溶液B选用浓硝酸,测得铜的质量分数偏大 |
| D、实验室中方案Ⅱ更便于实施 |
对于可逆反应A(g)+B(g)?C(g)△H<0,下列图象正确的是( )
A、 |
B、 |
C、 |
D、 |
 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.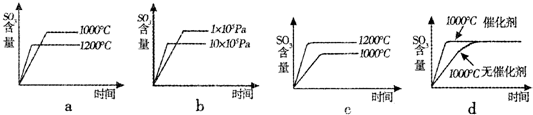
 为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线.请分析讨论以下问题.
为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线.请分析讨论以下问题.