题目内容
20. 在一定温度和压强条件下发生了反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0,反应达到平衡时,改变温度(T)和压强(p),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(p)的关系判断正确的是( )
在一定温度和压强条件下发生了反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0,反应达到平衡时,改变温度(T)和压强(p),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(p)的关系判断正确的是( )| A. | P3>P2T3>T2 | B. | P2>P4T4>T2 | C. | P1>P3T3>T1 | D. | P1>P4T2>T3 |
分析 根据平衡移动原理:增大压强,平衡向体积缩小的方向移动,温度升高,平衡向着吸热方向进行.在一定温度和压强条件下发生了反应:CO2(g)+3H2 (g)?CH3OH(g)+H2O(g)△H<0,增大压强,平衡正向移动,则反应混合物中甲醇(CH3OH)的物质的量分数逐渐增大,温度升高,平衡逆向移动,则反应混合物中甲醇(CH3OH)的物质的量分数逐渐减小,结合图象判断甲醇的物质的量分数变化情况判断.
解答 解:增大压强,平衡向体积缩小的方向移动,在一定温度和压强条件下发生了反应:CO2(g)+3H2 (g)?CH3OH(g)+H2O(g)△H<0,增大压强,平衡正向移动,则反应混合物中甲醇(CH3OH)的物质的量分数逐渐增大,即P1>P2>P3>P4,
温度升高,平衡向着吸热方向进行,在一定温度和压强条件下发生了反应:CO2(g)+3H2 (g)?CH3OH(g)+H2O(g)△H<0,温度升高,平衡逆向移动,则反应混合物中甲醇(CH3OH)的物质的量分数逐渐减小,故T1>T2>T3>T4,
故选D.
点评 本题考查化学平衡的影响因素以及化学平衡的计算知识,属于综合知识的考查,注意根据平衡移动原理分析解答,题目难度不大.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
10.NA为阿伏伽德罗常数的值.下列说法不正确的是( )
| A. | 高温下,0.2 molFe与足量水蒸气反应,生成的H2分子数目为$\frac{4}{15}$NA | |
| B. | 1molNa2O2固体中含离子总数为4NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA |
11.下列有关物质分类正确的是( )
| A. | NO2、CO、CO2均为酸性氧化物 | |
| B. | ${\;}_{8}^{16}$O2和${\;}_{8}^{18}$O2的质子数相同,互为同位素 | |
| C. | 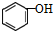 与 与 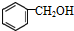 互为同系物 互为同系物 | |
| D. | 淀粉、纤维素和蛋白质都属于高分子化合物 |
8.设阿伏加德罗常数的值为N0,则下列说法正确的是( )
| A. | 标准状况下,22.4L乙烯含有的共用电子对数为2N0 | |
| B. | 常温下,含有1 mo1 NaHSO4的溶液中阳离子数为N0 | |
| C. | 通常状况下,1 mo1 NO和0.5 mo1 O2在密闭容器中混合,生成NO2分子数为N0 | |
| D. | 制取漂白粉时,标准状况下22.4 L Cl2参加反应,转移电子数为N0 |
5.某温度下,水的离子积为Kw,该温度下将a mol•L-1的一元酸HA与b mol•L-1的一元碱BOH等体积混合,若混合溶液显中性必须满足的条件是( )
| A. | a=b | B. | c(H+)=c(OH-)=10-7mol/L | ||
| C. | 混合液中Kw=c2(OH-) | D. | c(H+)+c(B+)=c(OH-)+c(A-) |
12.可在有机物中引入羟基的反应类型( )
①取代、②加成、③消去、④酯化、⑤氧化、⑥还原.
①取代、②加成、③消去、④酯化、⑤氧化、⑥还原.
| A. | ①②③ | B. | ①②⑤⑥ | C. | ①④⑤⑥ | D. | ①②③⑥ |
9.下列化学用语的表示不正确的是( )
| A. | Na2S的电子式: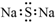 | |
| B. | HClO的结构式:H-O-Cl | |
| C. | 2,2-二甲基丙烷的结构简式: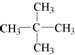 | |
| D. | 氯离子结构示意图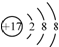 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- |
10.MnO2和锌是制造干电池的主要原料
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解,MnO2在电解池的阳极析出.
90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如下(中间产物的固体部分已经略去):
[软锰矿、闪锌矿]$\stackrel{步骤①:硫酸}{→}$[滤液A]$\stackrel{步骤②:金属棒}{→}$[Zn2+、Mn2+、Fe2+、Al3+]$\stackrel{步骤③:物质C}{→}$
[ZnSO4、MnSO4溶液]$\stackrel{步骤④:电解}{→}$[Zn+MnO2+产品D]
已知各种金属离子完全沉淀的pH如下表:
回答下列问题:
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+.产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用.
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解,MnO2在电解池的阳极析出.
90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如下(中间产物的固体部分已经略去):
[软锰矿、闪锌矿]$\stackrel{步骤①:硫酸}{→}$[滤液A]$\stackrel{步骤②:金属棒}{→}$[Zn2+、Mn2+、Fe2+、Al3+]$\stackrel{步骤③:物质C}{→}$
[ZnSO4、MnSO4溶液]$\stackrel{步骤④:电解}{→}$[Zn+MnO2+产品D]
已知各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+.产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用.
