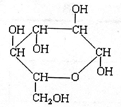
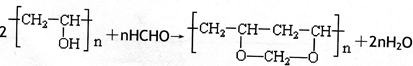题目内容
6.离子检验问题是考察元素化合物部分的重要知识点,请完成如下各离子检验所需的试剂及反应方程式.(1)铁离子(Fe3+):试剂KSCN溶液;反应离子方程式Fe3++3SCN-=Fe(SCN)3.
(2)有铁离子(Fe3+)的环境下检验是否含有亚铁离子(Fe2+):试剂:K3[Fe(CN)6],反应离子方程式3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.
(3)硫酸根离子((SO42-):试剂稀盐酸和氯化钡;反应离子方程式Ba2++SO42-=BaSO4↓.
分析 (1)三价铁离子与硫氰根离子发生络合反应生成血红色硫氰合铁络合物;
(2)K3[Fe(CN)6]与三价铁离子不反应,Fe2+与铁氰化钾K3[Fe(CN)6]反应生成铁氰化亚铁沉淀;
(3)硫酸根离子的检验,需加盐酸排除碳酸根离子干扰,再加入BaCl2溶液,有白色不溶于稀硝酸的沉淀产生,证明该离子存在.
解答 解:(1)三价铁离子与硫氰根离子发生络合反应生成血红色硫氰合铁络合物,离子方程式为Fe3++3SCN-=Fe(SCN)3,
故答案为:KSCN溶液,Fe3++3SCN-=Fe(SCN)3;
(2)含Fe2+的溶液与铁氰化钾K3[Fe(CN)6]溶液反应生成具有特征蓝色的铁氰化亚铁沉淀,离子方程式为:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓.
故答案为:K3[Fe(CN)6];3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;
(3)硫酸根离子的检验:向溶液中加入盐酸使之酸化,再加入BaCl2溶液,有白色沉淀产生,然后滴加稀硝酸沉淀不消失,证明含有硫酸根离子;
故答案为:稀盐酸和氯化钡;Ba2++SO42-=BaSO4↓.
点评 本题考查常见阴离子的检验,难度中等.要注意掌握常见离子的检验方法,避免相同反应现象的干扰.

练习册系列答案
相关题目
16.电离平衡常数是衡量弱电解质电离程度的量.已知如表数据(25℃):
(1)25℃时,等浓度的三种溶液(A.NaCN溶液、B.Na2CO3溶液、C.CH3COONa溶液)的pH由大到小的顺序为b>a>c.(填写序号)
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+CO2+H2O=NaHCO3+HCN.
(3)现有浓度为0.02mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是B、D.
A.c(H+)>c(OH-)
B.c(H+)<c(OH-)
C.c(H+)+c(HCN)=c(OH-)
D.c(HCN)+c(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);电荷守恒表达式c(OH-)+c(HC2O4-)+2c (C2O42-)=c(H+)+c(Na+).
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO4-+H+→CO2+Mn2++H2O,反应中每生成标况下4.48LCO2气体,转移的电子的物质的量为0.2mol.
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+CO2+H2O=NaHCO3+HCN.
(3)现有浓度为0.02mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是B、D.
A.c(H+)>c(OH-)
B.c(H+)<c(OH-)
C.c(H+)+c(HCN)=c(OH-)
D.c(HCN)+c(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);电荷守恒表达式c(OH-)+c(HC2O4-)+2c (C2O42-)=c(H+)+c(Na+).
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO4-+H+→CO2+Mn2++H2O,反应中每生成标况下4.48LCO2气体,转移的电子的物质的量为0.2mol.
14.丙烯酸的结构简式为CH2═CHCOOH,下列关于丙烯酸的说法错误的是( )
| A. | 丙烯酸所有原子可能共平面 | |
| B. | 丙烯酸可以发生取代反应 | |
| C. | 丙烯酸可以使酸性高锰酸钾溶液褪色 | |
| D. | 丙烯酸与HBr发生加成反应只能得到唯一产物 |
11.250C时,某溶液中由水电离出的c(OH-)=1×10-13mol/L,该溶液中一定不能大量共存的离子组是( )
| A. | NH4+、HCO3-、SO42-、Cl- | B. | CO32-、Cl-、K+、Na+ | ||
| C. | Na+、SO42-、CO32-、Cl- | D. | SO42-、Fe3+、Na+、K+ |
15.化学与社、生产、生活密切相关.下列说法不正确的是( )
| A. | 使用由CO2制备的聚碳酸酯降解塑料,可减少污染,实现碳的循环利用 | |
| B. | 铝合金因其密度小,硬度大,成为用量最大的合金 | |
| C. | 清洁燃料压缩天然气和液化石油气的主要成分是烃类 | |
| D. | 酱油加铁可以补充人体所需的铁元素 |

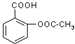 试根据阿斯匹林的结构回答;
试根据阿斯匹林的结构回答; ,其分子式为C7H6O3,则B的结构简式为CH3COOH;
,其分子式为C7H6O3,则B的结构简式为CH3COOH;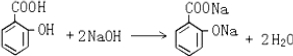 .
.
 (产物统称半缩醛)
(产物统称半缩醛)