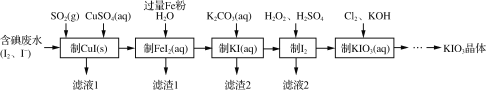
题目内容
【题目】电化学法还原二氧化碳,不仅能缓解温室效应还能得到乙烯。回答下列问题:
(1)已知:C2H4(g)+H2O(g)=C2H5OH(g) ΔH1=-45.8kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH2=-1277.0kJ·mol-1
则2CO2(g)+2H2O(g)=C2H4(g)+3O2(g)ΔH3=____。
(2)电化学法还原二氧化碳为乙烯原理如图所示。
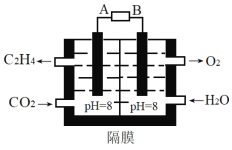
A为电源的___极(填“正”或“负”),阴极电极反应式为___。电路中转移0.2mol电子,理论上产生氧气___L(标准状况)。
(3)铜作阴极能提高还原产物乙烯的选择性,水溶液中二氧化碳在铜表面还原为乙烯的机理如图所示(参与反应的水分子及其它生成微粒未画出)。下列有关说法不正确的是___(填标号)。
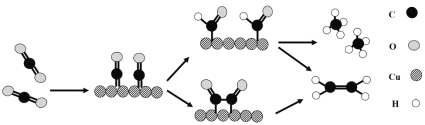
A.铜是二氧化碳转化为乙烯的催化剂
B.二氧化碳还原产物有甲烷和乙烯
C.两个反应历程都是先加氢再除氧
D.两个反应历程都出现碳氧键的断裂与碳碳键的形成
【答案】+1322.8kJ·mol-1 负 2CO2+8H2O+12e-=C2H4+12OH- 1.12 C
【解析】
(1)结合已知信息,根据盖斯定律解答;
(2)根据图知,加入水的电极上失电子生成氧气,则该电极为阳极,则通入二氧化碳的电极为阴极,连接阴极的电极为原电池负极,阴极上二氧化碳得电子和水生成乙烯和氢氧根离子;每生成1mol氧气转移4mol电子,据此计算转移0.2mol电子生成的氧气体积;
(3)A.根据图知,二氧化碳先和Cu反应,最后又生成Cu;
B.二氧化碳在反应中得电子发生还原反应,根据图知,二氧化碳还原产物还有甲烷;
C.生成乙烯是先除去氧后加氢;
D.两个反应历程中都有碳氧键的断裂和碳氢键的形成。
(1)①C2H4(g)+H2O(g)═C2H5OH(g)△H1=-45.8 kJ/mol
②C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H2=-1277.0 kJ/mol
根据盖斯定律,-(①+②)得方程式:2CO2(g)+2H2O(g)═C2H4(g)+3O2(g)△H3=(45.81277.0)kJ/mol=+1322.8 kJ/mol;
(2)根据图知,加入水的电极上失电子生成氧气,则该电极为阳极,则通入二氧化碳的电极为阴极,连接阴极的电极为原电池负极,则A为负极,阴极上二氧化碳得电子和水生成乙烯和氢氧根离子,电极反应式为2CO2+8H2O+12e=C2H4+12OH;每生成1mol氧气转移4mol电子,据此计算转移0.2mol电子生成的氧气体积=![]() ×1mol×22.4L/mol=1.12L;
×1mol×22.4L/mol=1.12L;
(3)A.根据图知,二氧化碳先和Cu反应,最后又生成Cu,则Cu作催化剂,故A正确;
B.二氧化碳在反应中得电子发生还原反应,根据图知,二氧化碳还原产物还有甲烷,所以二氧化碳反应还原产物有乙烯和甲烷,故B正确;
C.生成乙烯是先除去氧后加氢,而不是先除氢后除氧,故C错误;
D.两个反应历程中都有碳氧键的断裂和碳氢键的形成,形成碳氢键导致生成甲烷和乙烯,故D正确;
答案选C。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】H2是一种重要的清洁能源。
(1)已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.1kJmol-1
CO2(g)+H2(g) ΔH3=-41.1kJmol-1
H2还原 CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
A.高温 B.低温 C.任何温度条件下
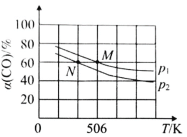
(2)恒温恒压下,在容积可变的密闭容器中加入 1molCO和2.2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
(3)若反应 CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是____(填字母);
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=___(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)=___kPamin-1。
【题目】甲、乙两同学为探究![]() 与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
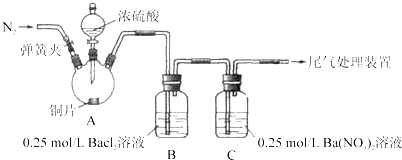
实验操作和现象:
操作 | 现象 |
关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡,B中有气泡冒出,产生大量白色沉淀,C中产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
从B、C中分别取少量白色沉淀,加稀盐酸 | 尚未发现白色沉淀溶解 |
(1)A中反应的化学方程式是_________________。
(2)C中白色沉淀是_______,该沉淀的生成表明SO2具有_______性。
(3)C中液面上方生成浅棕色气体的化学方程式是______。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①未证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是____;乙在A、B间增加洗气瓶D,D中盛放的试剂是______。
②进行实验,B中现象:
甲 | 大量白色沉淀 |
乙 | 少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:___。
(5)合并(4)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是_____。