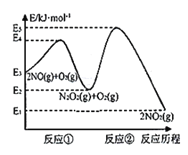
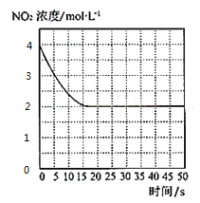
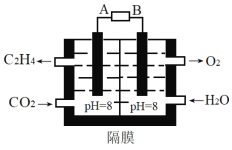
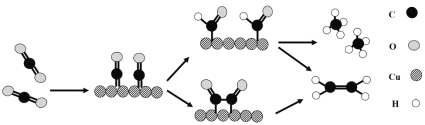
题目内容
【题目】目前碘酸钾被广泛应用于食盐加碘。一种由含碘废水制取碘酸钾的工艺如下:
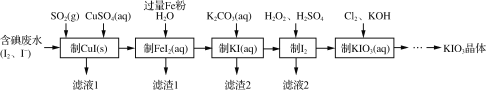
(1)检验“含碘废水”中是否含有单质I2,常用的试剂是______。
(2)通入SO2的目的是将I2还原为I-,该反应的离子方程式为________。
(3)滤渣1的成分为______。(写化学式)
(4)“制KIO3溶液”时,发生反应的离子方程式为___________。
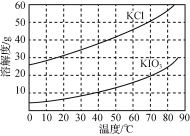
(5)KCl、KIO3的溶解度曲线如图所示。由上述流程中制得的KIO3溶液得到KIO3晶体的方法为____。
【答案】淀粉溶液 SO2+I2+2H2O=SO42-+2I-+4H+ Fe、Cu 5Cl2+I2+12OH-=2IO![]() +10Cl-+6H2O 蒸发浓缩,降温结晶
+10Cl-+6H2O 蒸发浓缩,降温结晶
【解析】
将含碘废水中通入SO2,将I2转化为I-,利于与Cu2+反应,生成CuI,加入过量Fe反应生成FeI2和Cu,将FeI2与K2CO3反应生成KI和沉淀,KI在硫酸酸性环境与H2O2反应生成I2,Cl2与I2在KOH溶液中反应生成KIO3、KCl和H2O。
(1)单质I2遇淀粉变蓝,因此检验“含碘废水”中是否含有单质I2,常用的试剂是淀粉溶液;
(2)通入SO2的目的是将I2还原为I-,自身被氧化为SO42,其反应的离子方程式为SO2+I2+2H2O = SO42+2I-+4H+;
(3)再制备FeI2过程中加入Fe与CuI反应生成Cu,由于Fe加入过量,因此滤渣1的成分为Fe、Cu;
(4)“制KIO3溶液”时,Cl2与I2在KOH溶液中反应生成KIO3、KCl和H2O,其发生反应的离子方程式为5Cl2+I2+12OH-=2IO3-+10Cl-+6H2O;
(5)KCl、KIO3的溶解度曲线如图所示,两者溶解度随温度升高,溶解度增加,KCl的溶解度大于KIO3的溶解度,流程中制得的KIO3溶液得到KIO3晶体的方法为蒸发浓缩,降温结晶。