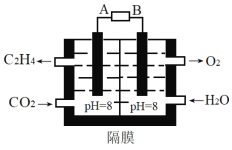
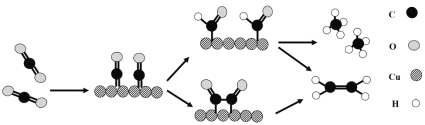
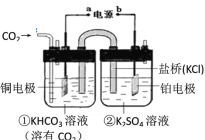
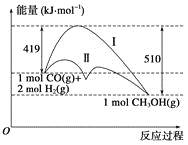
题目内容
【题目】电解质在水溶液中存在各种行为,如电离、水解等,依据所学知识回答下列问题:
(1)t℃时,纯水中c(H+)=1×10-6mol·L-1,该温度下,pH=10的NaOH溶液的物质的量浓度为___。
(2)25℃时,相同物质的量浓度的下列溶液中:①NaCl②NH3·H2O③H2SO4④(NH4)2SO4,其中水的电离程度由大到小顺序为___(填标号)。
(3)25℃时,将amol·L-1的醋酸和bmol·L-1的氢氧化钠溶液等体积混合后,溶液的pH=7,则a___b(填“>”“<”或“=”)。
【答案】0.01mol·L-1 ④①②③ >
【解析】
(1)t℃时,纯水中c(H+)=c(OH-)=1×10-6molL-1,则该温度下水的离子积常数KW=c(H+)c(OH-);该温度下,pH=10的Ba(OH)2溶液中c(OH-)=![]() mol/L=0.01mol/L,c(NaOH)= c(OH-);
mol/L=0.01mol/L,c(NaOH)= c(OH-);
(2)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中c(H+)、碱中c(OH-)越大其抑制水电离程度越大;
(3)25℃时,将amolL-1的醋酸和bmolL-1的氢氧化钠溶液等体积混合后,溶液的pH=7,则c(H+)=c(OH-),根据电荷守恒得c(Na+)=c(CH3COO-)=0.5bmol/L,溶液中存在物料守恒c(CH3COO-)+c(CH3COOH)=0.5amol/L。
(1)t℃时,纯水中c(H+)=c(OH)=1×106molL1,则该温度下水的离子积常数KW=c(H+)c(OH)=1×106×1×106=1012;该温度下,pH=10的NaOH溶液中c(OH)=![]() mol/L=0.01mol/L,c c(NaOH)= c(OH-)=0.01mol/L;
mol/L=0.01mol/L,c c(NaOH)= c(OH-)=0.01mol/L;
(2)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中c(H+)、碱中c(OH)越大其抑制水电离程度越大,①不影响水电离,②中c(OH)小于③中c(H+)且二者都抑制水电离程度,水电离程度②>③,④中铵根离子水解促进水的电离,所以水电离程度大小顺序是④①②③;
(3)25℃时,将amolL1的醋酸和bmolL1的氢氧化钠溶液等体积混合后,溶液的pH=7,则c(H+)=c(OH),根据电荷守恒得c(Na+)=c(CH3COO)=0.5bmol/L;溶液体积增大一倍,浓度是原来的一半,溶液中存在物料守恒c(CH3COO)+c(CH3COOH)=0.5amol/L>c(CH3COO)=0.5bmol/L,所以a>b。