题目内容
12.A~J是中学化学中常见的物质,其相互转化关系如下图所示,反应条件均已略去.A、B常温下均为无色液体,且均由两种相同的元素组成;C、F、G均为非金属单质,常温下C、F为无色气体,G为黄绿色气体;D是应用最广泛的金属;J溶液中滴入KSCN溶液显红色.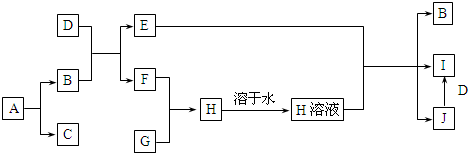 请回答下列问题:
请回答下列问题:(1)A的化学式是H2O2,G的化学式是Cl2.
(2)B+D→E+F的化学方程式是3Fe+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2.
(3)J+D→I的离子方程式是Fe+2Fe3+=3Fe2+.
(4)单质X是一种不溶于水的黄色固体,经过如下图所示的转化关系生成Y,反应条件均已略去.
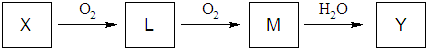
①将L气体通入紫色石蕊试液,现象是溶液变红色.
②常温下,向Y的浓溶液中加入金属D,观察到溶液中无明显现象,原因是常温下浓硫酸使铁钝化;加热后,观察到金属D与Y的浓溶液发生反应并有气体生成,且充分反应后发现金属D有剩余.则整个反应过程中生成的气体是SO2和H2,反应后所得溶液中的溶质是FeSO4.
分析 A、B常温下均为无色液体,且均由两种相同的元素组成,A生成B和C,C为气体,一般为H2O2生成H2O的反应,则A为H2O2,B为H2O,C为O2,G为黄绿色气体,应为Cl2,D是应用最广泛的金属,应为Fe,由转化关系可知F为H2,H为HCl,E为Fe3O4,J为FeCl3,I为FeCl2,
单质X是一种不溶于水的黄色固体,应为S,由转化关系可知 L为SO2,M为SO3,Y为H2SO4,结合对应单质、化合物的性质以及题目要求解答该题.
解答 解:A、B常温下均为无色液体,且均由两种相同的元素组成,A生成B和C,C为气体,一般为H2O2生成H2O的反应,则A为H2O2,B为H2O,C为O2,G为黄绿色气体,应为Cl2,D是应用最广泛的金属,应为Fe,由转化关系可知F为H2,H为HCl,E为Fe3O4,J为FeCl3,I为FeCl2,
(1)由以上分析可知A为H2O2,G为Cl2,故答案为:H2O2;Cl2;
(2)铁和水在加热条件下反应生成四氧化三铁和氢气,方程式为3Fe+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2,故答案为:3Fe+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2;
(3)J为FeCl3,I为FeCl2,FeCl3与Fe反应生成FeCl2,离子方程式为2Fe3++Fe=3Fe2+,故答案为:Fe+2Fe3+=3Fe2+;
(4)单质X是一种不溶于水的黄色固体,应为S,由转化关系可知 L为SO2,M为SO3,Y为H2SO4,
①二氧化硫为酸性气体,溶液呈酸性,可使石蕊变红色,故答案为:溶液变红色;
②常温下,铁与浓硫酸发生钝化反应,在表面生成一层致密的氧化膜,加入条件下浓硫酸与铁反应生成二氧化硫,随着反应的进行,硫酸浓度降低,生成氢气,如铁剩余,铁与铁离子反应,最终产物为硫酸亚铁,
故答案为:常温下浓硫酸使铁钝化;SO2和H2;FeSO4.
点评 本题考查无机物的推断,为高频考点,侧重考查元素化合物知识的综合理解和运用,把握过氧化氢、铁等物质的性质及其转化、电解原理等为解答的关键,注意A、B、J为解答的突破口,综合性较强,题目难度中等.

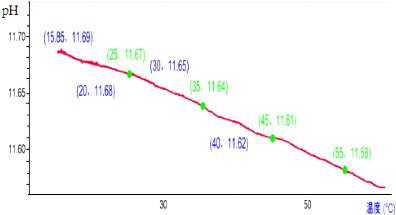
| A. | 随着温度升高溶液中c(OH-)不断减小 | |
| B. | 加热促进CO32-水解和水的电离,溶液中c(OH-)随温度升高而增大 | |
| C. | 溶液pH减小的原因是:加热促进水的电离,Kw随温度升高而增大 | |
| D. | 25℃时CO32-的水解程度约为100.67% |
①定容时仰视刻度线
②将浓硫酸在烧杯中稀释,转移到容积为100mL的容量瓶中后,没有洗涤烧杯
③在转移过程中用玻璃棒引流,因操作不慎有少量溶液流到了容量瓶外面
④最后定容时,加水超过了刻度,马上用胶头滴管吸去多余的水,使溶液凹液面刚好与刻度线相切.
| A. | ②③④ | B. | ③④ | C. | ①②③④ | D. | ①②③ |
| A. | 1克氢气的物质的量是1mol | |
| B. | 1.12升氢气为0.05mol | |
| C. | NaCl晶体中Na+、Cl- 的个数之比为1:1 | |
| D. | Cl2摩尔质量为71克 |
| A. | 2Na+O2$\frac{\underline{\;点燃\;}}{\;}$ Na2O2 | B. | HCl+NaOH═NaCl+H2O | ||
| C. | 2CaSO4═2CaO+2SO2↑+O2↑ | D. | Fe2O3+2Al $\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3 |
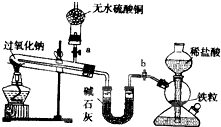 Na2O2是中学化学常用的强氧化剂,除了能与CO2、H2O反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况下,设计了如图所示装置进行有关实验.
Na2O2是中学化学常用的强氧化剂,除了能与CO2、H2O反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况下,设计了如图所示装置进行有关实验.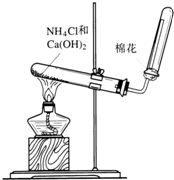 如图是实验室制取氨气的装置图.请回答:
如图是实验室制取氨气的装置图.请回答: